
10. Кинетическая теория газов
●128. Почему не двигалась тележка?
Сосуд, имеющий форму усеченного конуса, установлен на тележке (рис. 69) и заполнен газом. Так как площади АВ и CD различны, то будут различны и силы давления на них газа. Но тогда тележка должна двигаться влево. Однако этого не наблюдается. В чем ошибка рассуждений?
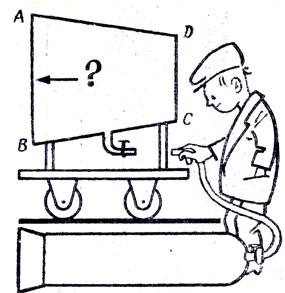
Рис. 69
○129. Изотермический процесс.
При изотермическом сжатии идеального газа его температура не изменяется, а следовательно, не изменяется и кинетическая энергия его молекул.
Так как между молекулами идеального газа нет сил притяжения и отталкивания, то при сжатии не изменилась и потенциальная энергия.
Но ведь сжатый газ приобретает способность совершить некоторую работу, т. е. обладает дополнительной энергией. Как разрешить это противоречие?
●130. Почему сохраняется температура газа?
По кинетической теории газов температура пропорциональна средней кинетической энергии движения его частиц. Молекулы газа при своем движении сталкиваются друг с другом и со стенками сосуда и в силу иеидеальной упругости теряют при ударе часть своей скорости, так что с течением времени температура газа должна уменьшаться. Сосуд же, содержащий газ, от ударов частиц должен нагреваться. Hto этого на практике не происходит. В чем ошибка рассуждений?
●131. Зависит ли конечное состояние газа от порядка выполнения процессов?
Пусть в цилиндре, закрытом поршнем (рис. 70), содержится газ, характеризуемый параметрами: р0, V0, t0° где t0° = 0°C. Нагреем газ на t° тогда его объем по закону Гей-Люссака будет равен V1 = V0(1γt°), давление по-прежнему р0. Создадим дополнительное давление на газ р1 так, чтобы довести его до прежнего объема V0. По закону Бойля - Мариотта имеем:
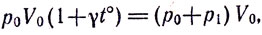
откуда
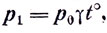
Рис. 70
Охладим теперь газ на t°, тогда он приобретет прежнюю температуру t°0 = 0°C, но объем его станет V2 = V0(1-γt°), давление (р0+p1). Чтобы довеститаз до прежнего объема, придется снять с поршня некоторое давление р2. Теперь объем газа V0, давление (p0+p1-р2), и, следовательно, по закону Бойля - Мариотта
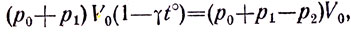
откуда
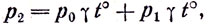
или, принимая в расчет, что 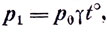 получим:
получим:
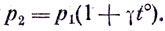
Так как t°≠0, то р2≠р1.
С другой стороны, проследив те изменения, которым мы подвергали газ, убеждаемся, что его конечный объем и температура такие же, как и в начале, поэтому и его давление (p0+p1-p2) должно быть равно прежнему p0, т. е. должно быть p0+p1-p2 = p0, откуда p2 = p1.
Где в рассуждениях была допущена ошибка?
○132. Температура газа.
При резком расширении большинство газов охлаждается (этот эффект используют для сжижения газов). Пусть в сосудах A и В, соединенных краном (рис. 71), содержится идеальный газ (А) и вакуум (В). Открываем кран. Газ врывается в сосуд В и... не охлаждается. Как объяснить этот парадокс?
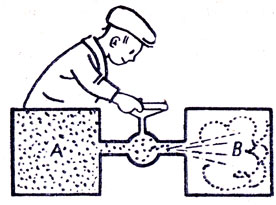
Рис. 71
○133. Откуда появилось добавочное давление?
Резервуар А (рис. 72) содержит воздух под давлением больше 1 ат и при температуре окружающей среды. Давление сжатого газа измеряется высотой ртутного столба в манометре. Открыв кран В, выпустили из резервуара столько газа, что ртутный столб в манометре понизился до высоты, соответствующей нормальному давлению. Спустя некоторое время было замечено, что ртуть в манометре снова несколько поднялась. Объясните парадокс.
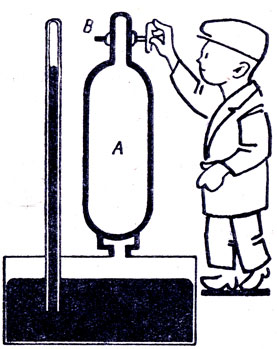
Рис. 72
●134. Неравные объемы равны.
Цилиндр А, снабженный поршнем Р (рис. 73), соединяет два неравных по емкости сосуда В и С, содержащие один и тот же газ при температуре 0°С. Пусть начальные объемы газов в сосудах (включая части цилиндра) VОB и VОС. Нагреем сосуд В на t° С, а С охладим тоже на t° С. Тогда поршень Р передвинется на некоторое расстояние по направлению стрелки.
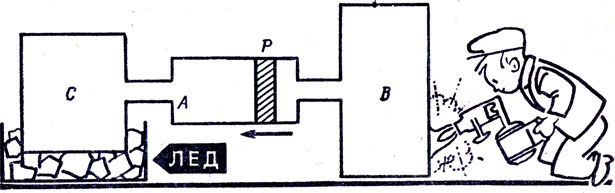
Рис. 73
Рассуждение первое.
Определим увеличение объема газа в сосуде В. Согласно закону Гей-Люссака ΔV1ΔVOBγt°. Соответственно уменьшение объема газа во втором сосуде составляет ΔV2 = - VOCγt°. Но так как сосуд В, цилиндр А и сосуд С представляют собой единый замкнутый резервуар, то увеличение объема одной его части равно уменьшению объема другой, т. е. ΔV1 = ΔV2, или VOBγt° = VOCγt°. Следовательно, VOB = VOC. Но мы вначале предположили неравенство VOB ≠ VOC. Как разрешить противоречие?
Рассуждение второе.
Как бы ни менялись объемы газов в сосудах В и С, общий объем
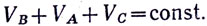
Пусть до изменения температуры суммарный объем был, включая и объем цилиндра, VOB + VOC а после нагревания стал V1 + V2. Тогда V0B + VOC = V1 + V2.
Но 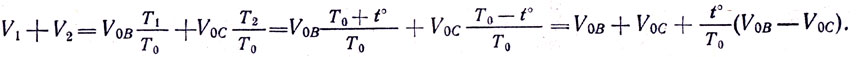
Итак, 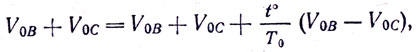
или 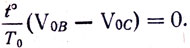
Следовательно, VOB - VOC, что также противоречит первоначально сделанному предположению о неравенстве объемов газов в сосудах. В чем ошибки обоих рассуждений?
|
ПОИСК:
|