
§ 20. Кристаллическое вещество
Твердые вещества могут быть кристаллическими или аморфными. Кристаллические вещества: металлы, кремнезем, гранит, песок, соль, лед и т. д. Кристалл - твердое тело, имеющее правильнее периодическое расположение составляющих его частиц (атомов, ионов, молекул). Кристаллы ограничены плоскими, упорядочение расположенными друг относительно друга гранями, сходящимися в ребрах и вершинах. Кристаллы одного и того же вещества могут отличаться по форме, но у них углы между соответствующими гранями и ребрами всегда одинаковы. Просвечивание кристаллов рентгеновскими лучами (рис. 21, а) и анализ полученных при этом фотографий подтвердили, что частицы, образующие кристалл, расположены в определенном порядке (рис. 21, б). По местонахождению пятен на рентгенограмме вычисляют расстояние между атомами в кристалле и устанавливают его строение.
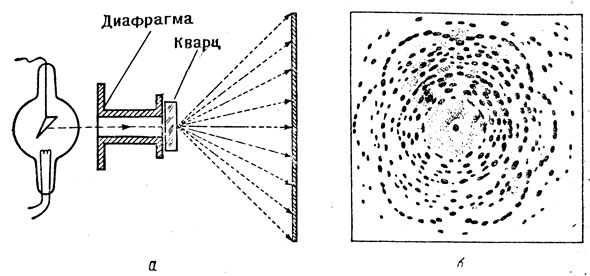
Рис. 21 Фотографирование кристалла рентгеновскими лучами
В кристаллических веществах из-за большого взаимного притяжения частицы, образующие кристаллы, колеблются около некоторого среднего положения (тепловое движение) и только изредка переходят с одного места на другое. Совокупность точек, соответствующих средним положениям частиц, составляющих кристалл, называется кристаллической решеткой. Чтобы нагляднее представить кристаллическую решетку, на рисунках размеры частиц и особенно расстояния между ними сильно увеличивают. Частицы, образующие кристалл, располагаются так, чтобы их потенциальная энергия взаимодействия была наименьшей. При этом молекулярные силы притяжения и отталкивания равны между собой.
Кристаллические решетки бывают: атомные, в узлах которых находятся нейтральные атомы данного вещества, например алмаза (рис. 22, а); молекулярные, в узлах которых расположены, нейтральные молекулы вещества, например льда (рис. 22, б); ионные, в узлах которых имеются ионы, например поваренной соли (рис. 22, б); металлические, состоящие из положительно заряженных ионов металла, находящихся в "атмосфере" электронного газа (рис. 22, г). Электроны и положительные ионы металла взаимно связывают друг друга: электроны не могут покинуть пределы металла благодаря притяжению к положительно заряженным ионам, а кристаллическая решетка, составленная из этих ионов, не разрушается из-за стягивающего действия электронного газа.
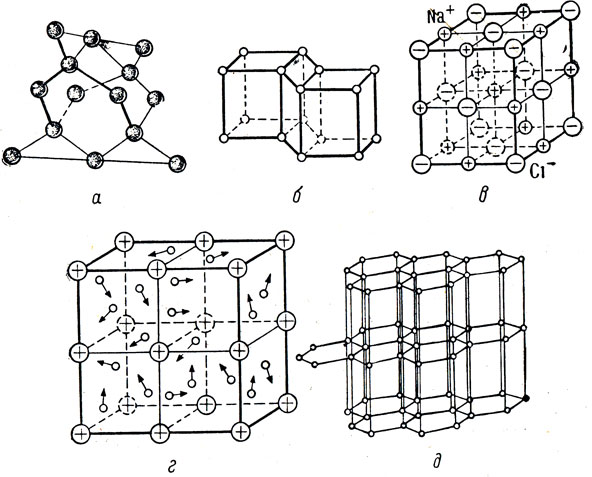
Рис. 22. Кристаллические решетки
Рассмотренные нами кристаллические решетки являются идеальными. Решетки реальных кристаллов обычно искажены: а некоторых узлах решетки могут отсутствовать молекулы, атомы, ионы этого вещества и находиться частица другого. Так как чужеродные атомы по своей физической природе и размерам отличаются от атомов основного кристалла, то их присутствие вызывает искажение - дефект его решетки. На рис. 23 показано влияние примеси на строение кристаллической решетки атома: при замене атома основного вещества (рис. 23, а); при внедрении примеси между атомами основного вещества (рис. 23, б), пои наличии "пустого" узла кристаллической решетки (рис. 23, в) Отклонение от идеальной формы решетки вызывает изменения физических свойств вещества. Дефекты в структуре кристаллической решетки нарушают плотную упаковку частиц кристалла, и молекулы, атомы, ионы могут меняться местами с соседними частицами. Вследствие этого возможны химические реакции и диффузия. Такие свойства, как прочность, пластичность, электропроводность, остаточная деформация, также зависят от присутствия инородных частиц в кристалле.
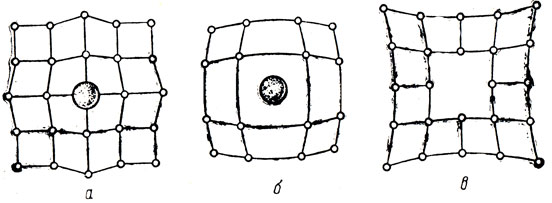
Рис. 23. Дефекты в кристаллической решетке атома
В кристалле частицы располагаются по различным направлениям на вполне определенных средних расстояниях одна от другой, причем эти расстояния весьма значительны по сравнению с размерами атома. Другими словами, наблюдается строгая периодичность расположения частиц в кристаллической решетке. Такой порядок в расположении частиц в кристалле называется дальним порядком. Кристалл - это тело, в котором существует трехмерный дальний порядок в расположении молекул, атомов, ионов.
Физические свойства кристаллических тел зависят от структуры и формы кристаллической решетки. Чтобы пояснить это, сравним две химически тождественные разновидности углерода - алмаз и графит. Физические свойства их настолько различны, что они кажутся совершенно разными веществами. Алмаз - тверд, прозрачен; графит - мягок, "мазуч", непрозрачен. Алмаз - непроводник тока, графит - проводник. Причиной столь резкого различия их свойств является разница в строении кристаллических решеток.
У алмаза между атомами по всему объему действует ковалентная связь, вследствие чего его твердость большая. Алмаз используют для сверления прочных горных пород, для изготовления резцов, сверл. Кристаллическая решетка графита построена иначе (рис. 22, д). В ней атомы углерода расположены слоями. По сравнению с расстоянием между атомами в алмазе (1,54*10-8 см) расстояние между слоями в графите велико (3,35*10-8см). А так как молекулярные силы очень быстро убывают с расстоянием, слои слабо удерживают друг друга. Например, когда мы пишем карандашом, то сдвигаем слой атомов углерода в кристаллической решетке графита.
Одиночные кристаллы называются монокристаллами. Они имеют форму правильных многогранников и по размеру бывают различны: от микроскопических до гигантов, как найденный в СССР кристалл кварца массой 13 т, длиной 3,5 м и шириной 1,6 м. Монокристаллами являются кристаллы алмаза, кварца, слюды, рубина. Большинство твердых веществ состоит из значительного числа сросшихся мелких хаотически расположенных кристалликов; такие вещества называются поликристаллическими. К ним относятся металлы, гранит, сахар-рафинад.
Характерной особенностью монокристаллов является то, что их физические свойства в различных направлениях не одинаковы. Неодинаковость физических свойств монокристаллов по разным направлениям называется анизотропией. Анизотропия кристаллов обнаруживается, например, при теплопроводности. Так, если гипсовую пластинку покрыть воском, и положить на него нагретый металлический шарик, то участок расплавленного воска будет иметь форму эллипса (рис. 24, а), что указывает на различную теплопроводность кристаллов гипса в разных направлениях. Кварцевый шар при нагревании принимает форму эллипсоида из-за того, что расширяется в различных направлениях неодинаково (рис. 24, б). Слюда легко расщепляется в одном направлении, в других - нет; значит, прочность ее различна по разным направлениям (рис. 24, в). Анизотропия также проявляется в распространении звука, света, электрического тока.
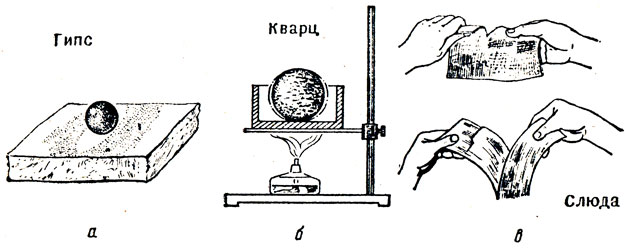
Рис. 24. Анизотропия монокристаллов
Анизотропия кристалла объясняется так: если в кристалле в двух каких-либо направлениях провести прямые, на которых будут лежать частицы кристалла (сделайте рисунок), то расстояние между частицами по этим направлениям, а следовательно, и плотность их расположения окажутся различными, что и является причиной неодинаковых физических свойств кристалла в разных направлениях.
Поликристаллические вещества по всем направлениям имеют одинаковые физические свойства. Это объясняется тем, что в данных веществах кристаллики расположены хаотично, отчего плотность расположения образующих их частиц по всем направлениям одинакова.
Чем меньше кристаллы, тем прочнее металл. С течением времени, а также под действием периодических нагрузок кристаллы в металлах укрупняются, что приводит к уменьшению их прочности, появляется так называемая усталость металла.
|
ПОИСК:
|