
§ 76. Законы Фарадея для электролиза
Когда ионы электролита доходят до электродов, соединенных с полюсами источника постоянного тока, то положительные ионы получают недостающие электроны от отрицательного электрода и в процессе реакции восстановления превращаются в нейтральные атомы (молекулы); отрицательные ионы отдают электроны положительному электроду и в процессе реакции окисления превращаются в нейтральные атомы. Явление выделения вещества на электродах в процессе окислительно-восстановительной реакции при прохождении тока через электролит называется электролизом. Впервые электролиз наблюдал в 1803 г. в Петербурге - В. П. Петров. В 1833-1834 гг. английский физик М. Фарадей открыл законы электролиза, которые устанавливают, от чего и как зависит масса выделившегося при электролизе вещества.
Пропуская в течение одинаковых промежутков времени ток одной и той же силы через разные электролиты, Фарадей установил, что при этом на электродах выделяются различные количества вещества. Так, ток в 1 а за 1 сек из раствора азотнокислого серебра выделяет 1,118 мг серебра, из раствора медного купороса - 0,328 мг меди. Значит, масса выделяемого вещества при электролизе зависит от вещества. Скалярная величина, измеряемая массой вещества, выделившегося при электролизе током в1 аза1 сек, называется электрохимическим эквивалентом (обозначается k). Электрохимический эквивалент имеет наименование кг/а*сек, или кг/к.
Если пропустить в течение времени t через раствор медного купороса небольшой ток, то катод слабо покрывается медью, а если ток большей силы - то за то же время на катоде выделится большее количество меди. Оставим силу тока той же, но увеличим теперь время. Замечаем, что меди выделяется еще больше. Пропуская через разные электролиты различные токи и тщательно измеряя массу вещества, выделяющегося на электродах из каждого электролита, Фарадей открыл первый закон электролиза: масса вещества, выделившегося при электролизе на электродах, прямо пропорциональна произведению силы тока и времени его прохождения через электролит.
Ток в 1 а за 1 сек при электролизе выделяет на электроде к кг вещества, а ток силой I а за время t сек - в It раз больше:
Это формулы первого закона Фарадея для электролиза.
Каждый ион несет с собой и определенную массу вещества и величину заряда, поэтому чем больше ионов подходит к электроду, т. е. чем сильнее ток в электролите, тем больше на электроде выделяется вещества.
Фарадей, пропуская один и тот же ток последовательно через несколько различных электролитов, заметил, что масса выделившегося на электродах вещества неодинакова, хотя сила тока и время его прохождения через различные электролиты были одними и теми же (рис. 109). Точно взвесив выделившиеся вещества, Фарадей заметил, что вес их не случаен, а зависит от химической природы вещества. На каждый грамм выделенного водорода всегда получалось 107,9 г серебра; 31,8 г меди; 29,35 г никеля. После введения химического эквивалента - отношения атомной массы (веса) к валентности 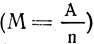 - оказалось, что эти числа являются химическими эквивалентами данных веществ. Так как атомная масса А и валентность n - числа отвлеченные, то и отношение
- оказалось, что эти числа являются химическими эквивалентами данных веществ. Так как атомная масса А и валентность n - числа отвлеченные, то и отношение 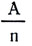 число отвлеченное.
число отвлеченное.
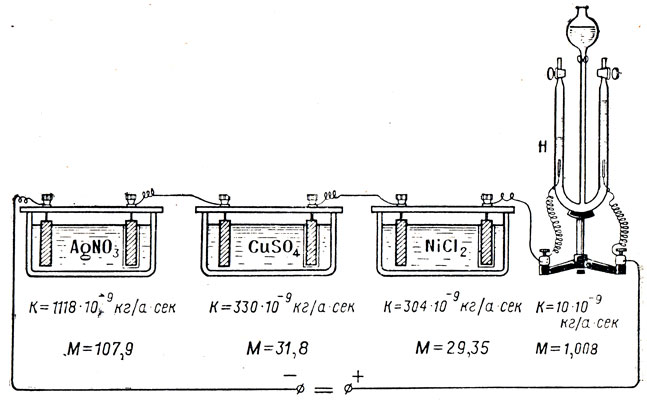
Рис. 109. Ко второму закону Фарадея для электролиза
Разделив электрохимические эквиваленты веществ на их химические эквиваленты, (k/M), получим:
для Ag 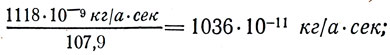
для Cu 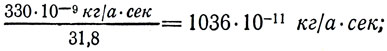
для Ni 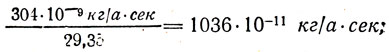
для Н 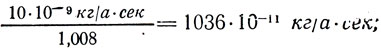
т. е. одно и то же число 1036*10-11кг/а*сек или 1036*10-11кг/к. Обозначив это постоянное число буквой С, запишем: C = 1036*10-11кг/а*сек. Следовательно, 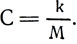 Отсюда электрохимический эквивалент
Отсюда электрохимический эквивалент
Это формула второго закона Фарадея для электролиза, который читается так: электрохимические эквиваленты веществ прямо пропорциональны их химическим эквивалентам.
Заменив электрохимический эквивалент в формуле первого закона Фарадея, получим формулу обобщенного закона Фарадея для электролиза:
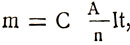
или
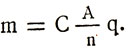
Массы выделившихся при электролизе веществ прямо пропорциональны их атомным весам и заряду, прошедшему через электролит, и обратно пропорциональны валентности вещества.
Законы Фарадея являются следствием ионной проводимости тока в электролите. Поясним это на таких примерах. Допустим, что производился электролиз одновалентных веществ, например растворов NaCl и AgNO3. Величины зарядов ионов Na и Ag одинаковы. Когда ионы переносят равные по величине заряды, как в том, так и в другом растворе к соответствующим электродам подойдет одинаковое количество ионов. Но при равном числе подошедших ионов массы отложившихся веществ Na и Ag будут не одинаковы, так как различны массы самих атомов Na и Ag. У натрия атомная масса 22,997; у серебра - 107,88; поэтому серебра выделится почти в пять раз больше. Значит, количество вещества, выделившегося при электролизе, прямо пропорционально его атомной массе, что и утверждается законом Фарадея.
В случае, когда в электролизе участвуют ионы разной валентности, например Аl, имеющий валентность, равную 3, и Na с валентностью, равной 1, количество ионов Аl и Na, переносящих один и тот же заряд, будет различно. Чем больше валентность иона, т. е. чем больше его заряд, тем меньшее количество ионов потребуется для переноса данного заряда (например, ионов Аl надо в три раза меньше, чем ионов Na). Такой зависимостью между валентностью и зарядом иона и объясняется то, что масса выделившегося при электролизе вещества обратно пропорциональна его валентности.
Благодаря простоте, дешевизне и большой чистоте полученных продуктов электролиз получил широкое применение в промышленности для добывания алюминия из бокситовых руд, очистки металлов (например, меди, цинка, золота, серебра) от примесей, покрытия металлических предметов слоем другого металла с целью предохранения их от ржавчины, придания твердости их поверхности (никелирование, хромирование), для изготовления украшений (серебрение, золочение), получения металлических копий с рельефных предметов (например, при изготовлении патефонных пластинок, матриц, клише).
Задача 30. Свинец высокой чистоты, применяемый в атомной энергетике, получают электрорафинированием. Вычислить массу свинца, выделенную за 1 ч током плотностью 0,02 а/см2 и напряжением 0,5 в. Выход по току 95%. Каков расход электроэнергии на выделение 1 кг свинца? Площадь общего сечения катодов, на которых отлагается свинец, 10 м2.

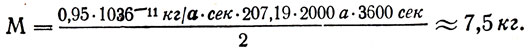
При к п. д. электролитической ванны 100% за счет всей израсходованной электроэнергии A = UIt выделилось бы свинца m = klt, поэтому на выделение 1 кг свинца израсходовано энергии 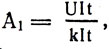 или
или 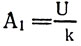
Вычислим
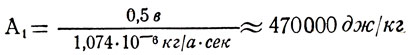
Отв.: М≈7,5 кг; А1 ≈ 470 кдж/кг.
Закажите море удовольствия с привлекательными спутницами Иваново на https://ivanovo.indigram.info.
|
ПОИСК:
|