
Структура ядра
Открытие изотопов и правила целых чисел поставило на очередь вопрос о структуре ядра. Вновь всплыла забытая гипотеза Праута о том, что водород является составной частью всех атомов. Э. В. Шпольский свой реферат о первых работах Астона озаглавил "Возрождение гипотезы Праута" и в заключительном абзаце этого реферата писал: "Работы Резерфорда и Астона служат новым могущественным стимулом к возрождению гипотезы Праута. Водород снова получает роль первичного элемента, и Резерфорд предложил даже для него и новое название, протон, соответствующее этой роли".
Термин "протон" был предложен Резерфордом на собрании Британской ассоциации в Кардиффе в 1920 г. Он предложил его по аналогии с термином "протил", введенным Праутом. Следует отметить, что термин "протон" не сразу завоевал право гражданства. Сам Резерфорд в своей лекции "Нуклеарное строение атома", прочитанной 3 июня 1920 г., еще его не употребляет. Не употребляет он его и в работах 1921, 1922 гг., посвященных расщеплению ядер. Нет этого термина в четвертом издании известной книги Зоммерфельда "Строение атома и спектры", вышедшем в 1924 г. О строении атомных ядер Зоммерфельд пишет: "Гипотеза Праута, нашедшая свое подтверждение в опытах Астона, требует, чтобы все атомные ядра в конечном счете были построены из ядер Н и электронов ("положительных и отрицательных электронов")". Еще в 1918 г. до опытов Астона В. Ленц пытался построить модель ядра гелия (α-частицы) из таких положительных и отрицательных электронов. Зоммерфельд подробно разбирает эту модель. Модель представляет собой четыре ядра водорода, вращающихся по окружности на равных расстояниях друг от друга вокруг оси, проходящей через центр этой окружности, перпендикулярно к ее плоскости. На концах оси по обе стороны плоскости окружности помещены отрицательные электроны. Напрашивается аналогия между этой моделью и моделью молекул в теории Бора. Действительно, Ленц называл эту модель "обращенной моделью кислородной молекулы". Поскольку же в боровских моделях молекул применяются квантованные орбиты, то и модель ядра Ленца основана на квантовых представлениях. Таким образом, мысль о применении квантовых закономерностей к внутриядерным движениям была высказана на самом раннем этапе развития ядерной физики. Модель Ленца также приписывала ядру гелия вращательный момент и поляризационные свойства, которые должны были проявить себя при рассеянии α-частиц. Однако, и в этом была главная причина ее несостоятельности, она не обладала требуемой устойчивостью. Ленд пытался спасти ее допущением, что на малых расстояниях неприменим закон Кулона. Опыты Резерфорда опровергли как это допущение, так и несостоятельность модели Ленца в других отношениях. Следует добавить, что опыты Резерфорда по расщеплению атомных ядер, о которых будет сказано ниже, явились веским аргументом в пользу гипотезы о протоне как составной части ядра, факты же радиоактивности указывали как будто на наличие внутри ядра α-частиц и β-частиц. Таким образом, в качестве структурных элементов ядра принимались три рода частиц: Н-ядра (протоны), электроны и α-частицы.

Д. Чедвик
Вернувшись из немецкого плена, Д. Чедвик приступил в Кембридже к работе под руководством Резерфорда. Одной из первых работ, выполненных им, была работа "Заряд атомного ядра и закон действия внутриатомных сил", опубликованная в 1920 г. Напомнив гипотезу ван ден Брука и работы Мозли, согласно которым атомный номер oсовпадает с зарядом ядра, Чедвик указывает, что эта связь все еще представляется недостаточно доказанной. "Весьма важно поэтому,- писал Чедвик,- измерить нуклеарный заряд прямым методом и сравнить полученную величину с атомным номером". Таким прямым методом явились опыты Резерфорда по рассеянию α-частиц. По Резерфорду, число частиц, рассеянных тонким слоем вещества под углом φ к первоначальному направлению, определяется формулой
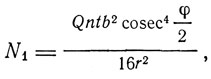
где N1 - число рассеянных частиц, приходящихся на единицу поверхности экрана, отстоящего на к сантиметров от точки падения пучка, Q - число частиц в секунду, падающих на рассеивающий слой, n - число атомов в единице объема рассеивающего слоя, t - толщина слоя,
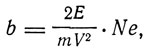
где Ne - ядерный заряд рассеивающего атома, m, V, Е - масса, скорость и заряд α-частицы.
Метод Чедвика позволял подсчитывать на одном и том же экране как рассеянные, так и первоначальные частицы, и тем самым, избежать источника ошибок, имевших место в опытах Гейгера и Марсдена. Для этого рассеивающая пластина бралась в виде кольцеобразной пластинки. Рассеянные и первоначальные частицы подсчиты-вались попеременно. При этом число рассеянных частиц составляет от одной пятисотой до одной тысячной числа частиц в первоначальном направлении. Чтобы облегчить подсчет большого числа первоначальных частиц на экране из сернистого цинка, на котором падающие α-частицы производили вспышки (сцинтилляции), Чедвик по предложению Резерфорда помещал вращающийся диск со щелью. Зная ширину щели и радиус диска, можно было подсчитать уменьшение потока частиц, производимого вращением диска. Результаты, полученные Чедвиком, следующие:
Платина - найденные значения N: 80,6(215); 79,4(226); 79,6(629); 76,0(367); 77,1(184); 78,5(277); 77,0(162); 76,5(278); 75,3(815); 76,5(345); 76,2(354).
В скобках Чедвик указывает число рассеянных частиц, сосчитанных во время опыта.
Среднее для платины значение заряда ядра оказывается равным 77,4, атомный номер платины Z = 78.
Серебро - найденные значения М: 46,0(453); 41,0(156); 44,0(190); 44,0(307); 45,9(529); 46,5(411); 49,1(224); 46,6(416); 49,1(297).
Среднее значение N = 46,3. Атомный номер серебра Z = 47.
Медь - найденные значения N: 27,8(125); 29,0(340); 29,6(369); 27,6(212); 29,6(178); 29,6(364); 30,0(377); 28,2(243); 30,4(351); 29,6(302).
Среднее значение N = 29,3, атомный номер меди Z = 29.
Таким образом, атомные номера в пределах точности измерений совпадают с зарядом ядра. Далее Чедвик проверял закон действующей силы. Если ядро взаимодействует с α-частицей по закону Кулона, то число рассеянных частиц должно быть обратно пропорционально четвертой степени скорости частиц (1/u4). Скорость α-частицы менялась внесением тормозящих слюдяных пластинок. Опыты дали следующие результаты:
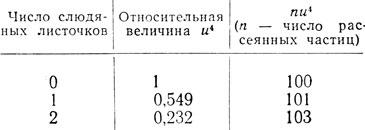
Таким образом, величина nu4 в пределах точности опыта оказывается постоянной. Итоги своих опытов Чедвик резюмирует в двух пунктах:
- "Заряды трех атомов - платины, серебра и меди - измерены прямым методом, основанным на изучении рассеяния α-частиц. Найденные величины оказались соответственно 77,4; 46,3 и 29,3 в элементарных электрических зарядах. Атомные номера этих элементов суть 78, 47 и 29.
- Был проверен закон действия силы около платинового ядра по зависимости рассеяния от скорости α-частицы. Результаты показывают, что закон обратных квадратов точно выполняется еще на расстояниях около 10-11 см от ядра".
3 июня 1920 г. Резерфорд прочитал Бакерианскую лекцию под названием "Нуклеарное строение ядра". В этой лекции, описывая свои опыты по столкновению α-частиц с легкими ядрами водорода, а также с ядрами кислорода и азота, Резерфорд приходит к заключению, что при этих столкновениях выбрасываются частицы с массой 3 и двойным зарядом. "Трудно избежать заключения,- писал Резерфорд,- что эти атомы с массой 3 освобождаются из атомов кислорода или азота в результате интенсивного столкновения с α-частицами. Таким образом, можно предположить, что атомы с массой 3 являются компонентами ядер как кислорода, так и азота. Мы уже раньше показали, что водород также является одним из компонентов ядра азота".
Через два года Резерфорд отказался от предположения о существовании частиц с массой 3. Но обратим внимание на логику физиков тех времен: для них является аксиомой, что если частица вылетает из ядра, значит, она там существовала. Поэтому существование α-частицы и электронов в ядре для них представлялось несомненным. "Из изучения радиоактивности,- говорил Резерфорд в этой лекции,- мы знаем, что ядра радиоактивных элементов частью состоят из ядра гелия с зарядом 2. Мы имеем также весьма солидные основания думать, что ядра атомов содержат наряду с положительно заряженными частицами, также и электроны и что положительный заряд ядра является избытком положительного заряда над отрицательным ... Внутри ядра электроны образуют весьма тесную и прочную комбинацию с положительно заряженными единицами".
Такой прочной комбинацией является ядро гелия (α-частица) и тот изотоп гелия с массой 3, который, как предполагал Резерфорд, "состоит из трех Н-ядер и одного электрона". В связи с этим Резерфорд делает интересное предположение: "Если это предположение (т. е. предположение о ядре с массой 3) правильно, то кажется весьма правдоподобным, что один электрон может связать два Н-ядра, а, возможно, даже и одно Н-ядро. Если справедливо первое предположение, то оно указывает на возможность существования атома с массою 2 и с одним зарядом. Такое вещество нужно рассматривать как изотоп водорода. Второе предположение заключает в себе мысль о существовании атома с массою 1 и нуклеарным зарядом, равным нулю. Подобное образование представляется вполне возможным".
Не первый раз в истории физики неверные предпосылки приводят к правильным следствиям; вспомним, например, теплород в цикле Карно. Предсказание нейтрона, дейтрона и других легких изотопов, сделанное Резерфордом, является в высшей степени замечательным. О будущем нейтроне он пишет: "Подобный атом обладал бы совершенно фантастическими свойствами. Его внешнее поле практически должно равняться нулю, за исключением областей, весьма близко прилежащих к ядру; вследствие этого он должен бы обладать способностью свободно проходить через материю. Существование подобного атома, вероятно, трудно было бы обнаружить спектроскопами, и его нельзя было бы удержать в закрытом сосуде. С другой стороны, он должен бы легко входить в структуру атома и либо соединиться с его ядром, либо разрушаться интенсивным полем этого последнего, давая начало заряженному Н-атому, или электрону, или тому и другому" (курсив мой.- П. К.). Как видим, Резерфорд предсказал даже распад нейтрона с образованием протона и электрона. История, в конце концов, оказалась справедливой к Кембриджу, где было сделано это предсказание. Чедвик, который так долго и безуспешно искал, по указанию Резерфорда, нейтрон в электрических разрядах через водород, стал автором открытия нейтрона.
|
ПОИСК:
|