
§ 2. Многоэлектронные атомы
Принцип запрета Паули. При рассмотрении вопроса о строении многоэлектронных атомов весьма важным является принцип запрета, сформулированный в 1925 году известным швейцарским физиком В. Паули. Согласно этому принципу в атоме в любом состоянии, описываемом набором четырех квантовых чисел (n, l, m, σ), не может находиться более одного электрона. Иначе говоря, на любой атомной стационарной орбите одновременно может находиться только один или два электрона, причем в последнем случае спины электронов должны иметь противоположные направления, то есть для одного электрона σ = +1/2, а для другого σ = -1/2.
Принимая во внимание принцип запрета Паули и зная количество стационарных орбит, характеризуемых различными квантовыми числами, можно точно определить возможное число электронов в каждой оболочке и подоболочке атома (см. табл. 1).
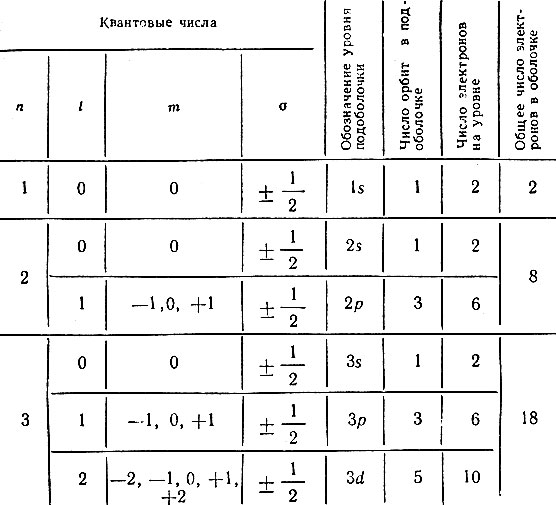
Таблица 1
Как расселяются электроны по оболочкам. Первая оболочка с главным квантовым числом n = 1 не делится на подоболочки, так как ей соответствует только одно значение l, равное нулю. А поскольку и m = 0, то можно сделать вывод, что первая оболочка состоит всего из одной орбиты, на которой согласно принципу Паули могут находиться всего два электрона.
Вторая оболочка (n = 2) состоит из двух подоболочек, так как l может быть равно 0 или 1. В атомной физике при описании подоболочек принято вместо численных значений l употреблять буквенные обозначения. Так, независимо от значения главного квантового числа n все подоболочки, характеризуемые значением l = 0, обозначаются буквой s, подоболочки с l = 1 обозначаются буквой р, при l = 2 вводится обозначение d и т. д. В связи с этим говорят, что вторая оболочка состоит из s- и р-подоболочек. При этом s-подоболочка (l = 0) состоит из одной круговой орбиты и в ней могут расположиться всего два электрона, в то время как р-подоболочка состоит из трех орбит (m может быть равно -1, 0 и +1) и на ней могут находиться шесть электронов. Общее же число электронов, могущих расположиться на второй оболочке, равно восьми.
Аналогичным образом можно подсчитать возможное число электронов на любой оболочке и подоболочке. Например, на 3d-подоболочке (n = 3, l = 2) может быть 10 электронов: по два электрона на каждой из пяти орбит, характеризуемых различными значениями квантового числа m. Максимальное число электронов, могущих разместиться в той или иной подоболочке, равно 2(2l + 1). В спектроскопии различным оболочкам обычно присваивают буквенные обозначения - термы: первая оболочка обозначается буквой K, вторая - L, третья - М и т. д.
В то время как в атоме водорода единственный электрон находится в центрально-симметричном поле атомного ядра и энергия электрона определяется только значением главного квантового числа n и не зависит от значений остальных квантовых чисел, в многоэлектронных атомах каждый электрон находится в поле, создаваемом как ядром, так и остальными электронами. Поэтому энергия электрона в многоэлектронных атомах оказывается зависящей не только от главного квантового числа n, но и от орбитального числа l. При этом она остается независимой от значений m и σ.
Такая специфика многоэлектронных атомов приводит к существенным отличиям их энергетического спектра от спектра атома водорода. На рисунке 4 приведена часть спектра многоэлектронного атома (энергетические уровни трех первых оболочек атома). Кружочки на уровнях обозначают максимальное число электронов, могущих расположиться в соответствующей подоболочке.
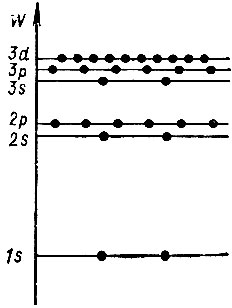
Рис. 4
Известно, что всякая система, будучи представлена самой себе, стремится перейти в состояние с наименьшей энергией. Не является в этом смысле исключением и атом. При заполнении оболочек атома электроны стремятся занять самые нижние уровни, и если бы не ограничения, выражаемые принципом запрета Паули, то они все расположились бы на первом уровне. В атоме водорода единственный электрон занимает самую нижнюю орбиту, принадлежащую уровню 1s. В атоме гелия на этой же орбите располагается и второй электрон, и первая оболочка атомной структуры оказывается заполненной. Отметим, что гелий является инертным газом, и его высокая устойчивость обусловлена именно заполненностью внешней оболочки.
В атоме лития имеются всего три электрона. Два из них располагаются в первой оболочке, а третий - во второй оболочке с n = 2 (его размещение на первой оболочке запрещено принципом Паули). Литий является щелочным металлом с валентностью, равной 1. Это означает, что электрон, находящийся на второй оболочке, слабо связан с атомным остатком и легко отделяется от него. Об этом можно судить и по значению потенциала ионизации, который для лития равен всего 5,37 В, тогда как для гелия он равен 24,45 В.
По мере увеличения числа электронов в атомах происходит заполнение лежащих выше подоболочек и оболочек. Так, начиная с бора, имеющего 5 электронов, происходит заполнение 2p-подоболочки, завершающееся в атоме неона, имеющего полностью заполненную вторую оболочку и характеризующегося благодаря этому высокой стабильностью инертного газа. Одиннадцатый электрон в атоме натрия начинает заселение третьей оболочки (подоболочки 3s) и т. д.
|
ПОИСК:
|