
Глава 2. Электропроводность твердых тел
§ 7. Силы связи в кристаллической решетке
Кристалл - система атомов, находящаяся в состоянии устойчивого равновесия. Что определяет образование из отдельных атомов строго упорядоченной кристаллической решетки? Почему в процессе образования кристалла атомы не могут неограниченно сближаться, чем определяется прочность кристалла?
В поисках ответа на эти вопросы мы должны предположить, что существуют силы притяжения Fпр и силы отталкивания Fот между атомами, приходящие в равновесие при образовании кристаллической структуры. Независимо от природы этих сил характер их зависимости от расстояния между атомами оказывается одинаковым (рис. 11, а). На расстоянии r > a0 преобладают силы притяжения; при r < a0 большими оказываются силы отталкивания. На некотором расстоянии r = a0, вполне определенном для данного кристалла, силы притяжения и отталкивания уравновешивают друг друга, и результирующая сила Fp (ход которой отражает кривая 3) становится равной нулю. Энергия взаимодействия между частицами при этом достигает наименьшего значения Wкр (рис. 11, б). Поскольку энергия взаимодействия при r = а0 минимальна, то в отсутствие внешнего возбуждения атомы не могут уйти из этого положения: как удаление атомов друг от друга, так и дальнейшее их сближение приводит к увеличению энергии взаимодействия. Такая ситуация означает, что при r = а0 рассматриваемая система атомов находится в состоянии устойчивого равновесия. Это состояние как раз и соответствует образованию твердого тела со строго определенной внутренней структурой - кристалла.
Силы отталкивания и силы притяжения. Силы отталкивания, как видно из хода кривой 2 на рисунке 11, очень быстро возрастают с уменьшением расстояния r между атомами. Преодоление этих сил связано с затратой больших энергий. Например, при сближении протона с атомом водорода уменьшение расстояния от r = 2a до

(где а - радиус первой боровской орбиты) сопровождается возрастанием энергии отталкивания в 300 раз. Отталкивание легких атомов, ядра которых слабо экранированы электронными оболочками, обусловлено в первую очередь взаимодействием ядер. В случае же сближения многоэлектронных атомов отталкивание объясняется взаимодействием внутренних заполненных электронных оболочек. При этом отталкивание происходит не только потому, что электронные оболочки имеют одинаковый знак заряда, но и потому, что при сближении атомов происходит перестройка электронных оболочек. На очень малых расстояниях должно происходить перекрытие электронных оболочек и возникновение орбит, общих для обоих атомов. Однако поскольку на первичных заполненных орбитах все места заняты и появление избыточных электронов на них согласно принципу Паули невозможно, то определенная часть электронов должна перейти на более высокие оболочки. Такой переход связан с повышением общей энергии системы, чем и объясняется проявление сил отталкивания.
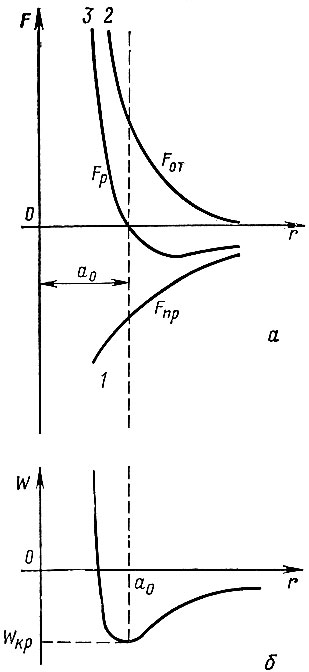
Рис. 11
Как видно, природа сил отталкивания является в определенной степени общей для всех атомов и не зависит от строения внешних, незаполненных оболочек. В противоположность этому природа сил притяжения между атомами оказывается гораздо более разнообразной и определяется она как раз строением и степенью заполненности внешних электронных оболочек. В соответствии с природой сил притяжения получили название и силы связи в целом. Наиболее важными при рассмотрении строения кристаллов являются ионная, ковалентная и металлическая связи, известные из школьного курса химии. Мы остановимся на рассмотрении только ковалентной связи, определяющей основные свойства полупроводниковых кристаллов.
Ковалентная связь играет основную роль при образовании молекул или кристаллов из одинаковых или однородных атомов. Естественно, что при взаимодействии одинаковых атомов не происходит передача электронов от одного атома к другому и образование ионов. Однако процесс перераспределения электронов и здесь играет основную роль. Но в этом случае перераспределение завершается не переходом какого-либо электрона от одного атома к другому, а обобществлением некоторых электронов: определенные электроны оказываются принадлежащими одновременно нескольким атомам.
Рассмотрим образование ковалентной связи в молекуле водорода Н2. Пока оба атома водорода находятся на достаточно большом расстоянии друг от друга, каждый из них "владеет" своим электроном, и вероятность обнаружить в пределах данного атома "чужой" электрон ничтожно мала. Так, при расстоянии между атомами r = 5 нм каждый из электронов может появиться в соседнем атоме один раз в 1012 лет. По мере сближения атомов вероятность появления "чужого" электрона резко возрастает. При r = 0,2 нм частота перехода достигает уже  а при дальнейшем сближении частота обмена электронами между атомами становится настолько большой, что "свой" и "чужой" электроны появляются одинаково часто у обоих ядер. В этом случае говорят, что электроны обобществлены. Связь, основанная на "совместном владении" атомами двумя электронами, и называется ковалентной.
а при дальнейшем сближении частота обмена электронами между атомами становится настолько большой, что "свой" и "чужой" электроны появляются одинаково часто у обоих ядер. В этом случае говорят, что электроны обобществлены. Связь, основанная на "совместном владении" атомами двумя электронами, и называется ковалентной.
Создание ковалентной связи, естественно, должно быть выгодно и с энергетической точки зрения. На рисунке 12 кривая 1 отражает ход суммарной энергии двух атомов водорода по мере их сближения (за нулевой уровень принята суммарная энергия двух бесконечно удаленных атомов водорода, не взаимодействующих друг с другом). Мы видим, что по мере сближения атомов их суммарная энергия уменьшается, достигая минимума при r = а0, соответствующего расстоянию между атомами в молекуле водорода.
Не всякие два атома водорода могут создать молекулу. Описанный процесс образования молекулы водорода возможен только в том случае, если электроны в объединяющихся атомах имеют противоположно направленные спины. Лишь при различной ориентации спинов электроны могут расположиться на одной электронной орбите, являющейся общей орбитой для объединенных атомов. Если же в сближающихся атомах водорода электроны имеют одинаково направленные спины, то есть находятся в одном и том же состоянии, определяемом одинаковым набором всех четырех квантовых чисел (n, l, m и a), то согласно принципу Паули они не могут разместиться на одной и той же орбите. Такие атомы по мере сближения будут не притягиваться, а отталкиваться, а их суммарная энергия с уменьшением r будет не уменьшаться, а возрастать (кривая 2 на рисунке 12). Ясно, что в этом случае образования молекулы не происходит.
Важнейшей особенностью ковалентных связей является их насыщаемость. Свойство это также связано с проявлением принципа Паули и заключается в невозможности участия в создании ковалентной связи третьего электрона. Объединившись в одну ковалентную связь, электроны уже не могут создать другой связи и в то же время "не разрешают" другим электронам проникнуть на созданную объединенную орбиту. Именно поэтому, например, молекула водорода состоит из двух атомов и не может быть создана молекула Н3.
Полупроводники - типичные представители ковалентных кристаллов. Наиболее характерные черты ковалентных связей просматриваются в кристаллах, имеющих структуру алмаза. Типичными представителями этой группы являются кристаллы полупроводников, среди которых наиболее известны кремний и германий. Атомы этих элементов имеют на внешней оболочке по четыре валентных электрона, каждый из которых создает по одной ковалентной связи с четырьмя близлежащими соседями (рис. 13). Образуя ковалентную связь с соседом, атом отдает в "частичное пользование" один из своих валентных электронов и одновременно приобретает электрон соседа на тех же основаниях. В результате каждый из атомов, образующих кристалл, как бы достраивает свою внешнюю оболочку до полной заселенности (по 8 электронов), создавая устойчивую структуру, аналогичную структуре атомов инертных газов (на рисунке 13 эти 8 электронов условно расположены на круговой орбите, обозначенной пунктиром). Благодаря неразличимости электронов и возможности обмена электронами между атомами все валентные электроны в одинаковой степени принадлежат всем атомам кристалла. Кристалл полупроводника предстает как одна гигантская молекула, в которой атомы соединены между собой ковалентными связями. На рисунках такие кристаллы условно отображаются плоскостной фигурой (рис. 14), где каждая двойная линия между атомами обозначает ковалентную связь, образованную двумя электронами.
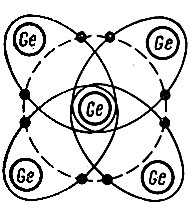
Рис. 13
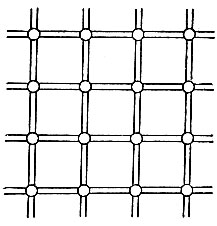
Рис. 14
|
ПОИСК:
|