
Структура вещества
Принято считать, что любое вещество состоит из атомов. Каждый атом имеет ядро, которое образовано из плотно "упакованных" относительно массивных частиц, нейтронов и протонов; последние определяют его положительный электрический заряд. В целом атом электрически нейтрален, поскольку вокруг ядра вращаются электроны, каждый из которых заряжен отрицательно и имеет относительно малую массу. Для наших целей вполне применима модель атома, предложенная Бором (1913). Установлено, что для электронов в атоме разрешены только определенные орбиты, которые заполняются в строгой последовательности и образуют оболочки вокруг ядра. Каждая оболочка может содержать некоторое максимальное количество электронов, однако во многих атомах оболочки заполнены не до конца. Химическое соединение атомов в молекулы происходит в результате соединения внешних оболочек, и число электронов на этих оболочках определяет, какие элементы могут вступать во взаимодействие друг с другом и каковы свойства получаемых при этом соединений. Способность элементов вступать во взаимодействия характеризуется валентностью, а электроны внешней оболочки соответственно называются валентными электронами. У электрических проводников, в частности металлов, некоторые электроны находятся столь далеко от ядра и так слабо с ним связаны, что их нельзя считать принадлежащими определенному атому или молекуле. В любом теле всегда существует достаточное количество электронов, благодаря чему оно остается электрически нейтральным, но сами-электроны могут относительно свободно перемещаться внутри тела.
В теле между атомами и молекулами действуют силы электростатического взаимодействия. Предполагается, что результирующая сила взаимодействия между двумя покоящимися атомами меняется с расстоянием между их центрами так, как показано на рис. 15. Оказывается, эта сила складывается из двух: силы отталкивания, которая очень быстро уменьшается с расстоянием, и силы притяжения, которая также уменьшается с расстоянием, но гораздо медленнее. Если два атома сближаются, сила их взаимодействия сначала определяется притяжением, увеличивающимся по мере их сближения до точки A, где начинает сказываться отталкивание. С этого момента отталкивание становится преобладающим и результирующая сила быстро падает, пройдя через нулевое значение в точке Б. Два атома, находящиеся в состоянии покоя на расстоянии Б друг от друга, должны оставаться на этом расстоянии, поскольку действующие на них внешние силы взаимно уравновешиваются.
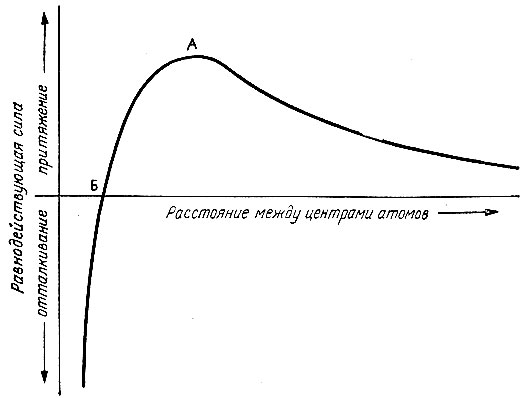
Рис. 15. Сила взаимодействия между атомами
В действительности атомы и молекулы никогда не находятся в состоянии покоя. В твердом теле, где они в основном расположены в пределах некой регулярной (структуры, называемой решеткой, они сохраняют свое положение вблизи равновесной точки Б (хотя их положение зависит и от их ближайших соседей), относительно которого они совершают колебательные движения. Как видно из рис. 15, в точке Б сила отталкивания с уменьшением расстояния увеличивается значительно быстрее, чем направленная в противоположную сторону сила притяжения. При колебательном движении атомов их смещения различны в разных направлениях, в результате чего их равновесное положение смещается относительно точки Б. Как мы увидим позже, с повышением температуры размах, или амплитуда, таких колебаний возрастает. Следовательно, расширение вещества при нагревании обусловлено увеличением среднего расстояния между атомами, что является результатом их более интенсивного колебательного движения.
Дальнейший рост амплитуды колебаний приводит к разрушению регулярной структуры, характерной для твердого состояния, и более свободному размещению атомов, которое присуще жидкому состоянию. Расстояние между атомами и молекулами в жидкости больше, чем в твердом теле, но они все еще продолжают находиться под действуем сил притяжения и отталкивания. При газообразном состоянии движение молекул становится достаточно интенсивным, и они утрачивают связь друг с другом. Перемещаясь во всех направлениях, молекулы сближаются и удаляются друг от друга, не вступая в постоянное взаимодействие; они могут "разлететься" настолько, что заполнят любой резервуар, в который их помещают. Тем не менее именно благодаря их частым сближениям, приводящим к столкновениям, в любой момент времени в объеме газа поддерживается некоторая средняя скорость, хотя скорости отдельных молекул всегда отличаются от нее в ту или иную сторону.
|
ПОИСК:
|