
ГЛАВА ВТОРАЯ
Лучи - Атомы - Электроны - Атомы, электроны, лучи
В истории человечества нам интересны не имена государей и не даты их правления — хотя без этого история не существует вообще, а рождение, расцвет и упадок цивилизаций, эволюция и существо идей, которые столетиями направляют волю людей и определяют характер их взаимоотношений; в истории мы хотим понять причины обновления идей и обстоятельства их угасания.
Глава вторая
Точно так же история физики — это не просто набор фактов, а связная картина возникновения и развития физических идей, без которых наука может показаться произвольным набором формул и понятий.
Истины плодотворны только тогда, когда между ними есть внутренняя связь, а связь эту можно проследить только в развитии.
Даже дикари на низшей ступени развития имеют свою историю. С утратой истории исчезнет связь времен, и люди перестанут быть людьми, точно так же, как отдельный человек, утратив память, необратимо деградирует.
Для физика история его науки — необходимый элемент образования, без которого он всегда останется ремесленником. Для всех остальных — это большей частью история человеческих судеб, которые подчас настолько же необычны, как и судьбы царей или полководцев.
Чтобы понять законченность и красоту понятий современной физики, необходимо проследить их истоки и путь развития. Только после этого они смогут стать вам близкими и понятными — точно так же, как близка вам родина, историю и культуру которой вы впитали с молоком матери.
Знаменитый математик Феликс Клейн говорил как-то, что самый быстрый и надежный путь овладеть любой наукой — пройти самому весь путь ее развития. Это не самый простой путь, но он самый интересный, и мы избрали именно его.
В дальнейшем нам особенно важно проследить эволюцию понятий: лучи, атомы, электроны, чтобы в конце пути почувствовать красоту их синтеза.
ЛУЧИ
Cолнечный луч, если внимательно за ним проследить, может привести к порогу квантовой физики. Весьма вероятно, что вам этот переход не кажется пока убедительным. Но ощущение произвола, которое испытывает человек при первом знакомстве с теорией Планка, на самом деле обманчиво. Формула Планка не результат умозрения, она появилась лишь после длительного анализа точных опытов. Конечно, чтобы придумать ее, одного анализа мало: необходима еще и сила мысли, и взлет фантазии, и смелость перед лицом неожиданных следствий теории.
Ученые Релей, Джинс, Вин и до Планка предлагали различные формулы для описания спектра абсолютно черного тела. Но каждый раз экспериментаторы Отто Люммер (1860—1925) и Эрнст Принсгейм (1859—1917) после тщательного измерения этого спектра решительно отвергали их, как несовершенные. Только формула Планка удовлетворила их: она поразительно совпала с результатами их опытов, хотя и не становилась от этого более понятной.
Последуем примеру этих физиков и рассмотрим строение солнечного луча еще внимательнее, чем мы это делали до сих пор. В дальнейшем мы увидим, как много информации он с собой несет, и надо только научиться ее читать.
Если пропустить луч солнца через призму, то на экране позади нее возникает спектр — явление обычное, и за двести лет к нему привыкли. На первый взгляд между отдельными частями спектра нет резких границ: красный непрерывно переходит в оранжевый, оранжевый в желтый и т. д.
Так и думали до тех пор, пока в 1802 году английский врач и химик Уильям Хайд Волластон (1766— 1828) не рассмотрел этот спектр более пристально. Он обнаружил при этом несколько резких темных линий, которые без видимого порядка пересекали спектр Солнца в разных местах. Он не придал им особого значения, полагая, что их появление зависит либо от качества призмы, либо от источника света, либо от других побочных причин. Да и сами линии он считал интересными только потому, что они отделяют друг от друга цветные полосы спектра. Впоследствии эти темные линии назвали фраунгоферовыми — по имени их настоящего исследователя, а не первооткрывателя.
Иосиф Фраунгофер (1787—1826) прожил недолго, но у него была удивительная судьба. В 11 лет, после смерти родителей, он пошел в ученье к шлифовальных дел мастеру. Работать приходилось так много, что на школу уже не оставалось времени, и потому до 14 лет он не умел ни читать, ни писать. Но однажды дом хозяина рухнул; и случилось так, что пока Фраунгофера извлекали из-под обломков, мимо проезжал наследный принц. Он пожалел юношу и вручил ему значительную сумму денег. Их оказалось достаточно, чтобы Иосиф смог купить себе шлифовальный станок и даже начать учиться.
То было время наполеоновских войн и больших перемен в Европе. А Фраунгофер между тем в заштатном городке Бенедиктбейрене учился, шлифовал оптические стекла и тщательно исследовал темные линии в спектре Солнца. Он насчитал их там 574, дал главным названия и указал их точное местоположение в спектре. Положение это было строго неизменным, в частности, всегда в одном и том же месте желтой части спектра появлялась резкая двойная линия, которую Фраунгофер назвал линией D.
И еще один важный факт установил Фраунгофер: в спектре пламени спиртовки на том же самом месте, где и темная линия D в спектре Солнца, всегда присутствует яркая двойная желтая линия. Значение этого факта оценили только много лет спустя.
В 1819 году Фраунгофер переехал в Мюнхен и стал там профессором, членом Академии наук и хранителем физического кабинета. Продолжая свои исследования темных линий в спектре Солнца, он убедился, что их причина не оптический обман, а сама природа солнечного света. Побуждаемый странной природой этих линий к дальнейшим наблюдениям, он открыл их затем в спектре Венеры и Сириуса.
Иосиф Фраунгофер умер и похоронен в Мюнхене в 1826 году. На его могиле надпись: «Approximavit sidera — Приблизил звезды». Но лучший памятник ему — его открытия.
Среди открытий Фраунгофера для нас особенно важно сейчас его наблюдение над двойной D-линией. Тогда, в 1814 году, когда он опубликовал свои исследования, на это наблюдение особого внимания не обратили. Однако труды его не пропали: прошло 43 года, и Вильям Сван (1828—1914) установил, что двойная желтая линия D в спектре пламени спиртовки возникает в присутствии металла натрия. (Его следы в составе поваренной соли почти всегда можно найти в различных веществах, и в спиртовке — тоже.) Как и многие до него, Сван не понял значения своего открытия и потому не сказал решающих слов: «Эта линия принадлежит металлу натрию».
К этой простой и важной мысли пришли только два года спустя (в 1859 году) два профессора: Густав Роберт Кирхгоф (1824—1887) и Роберт Вильгельм Бунзен (1811—1899). В Гейдельберге, в старой университетской лаборатории, они поставили несложный опыт. До них через призму пропускали либо только луч Солнца, либо только свет от спиртовки. Кирхгоф и Бунзен пропустили и то и другое сразу и обнаружили явление, о котором стоит рассказать подробно.
Если на призму падал только луч Солнца, то на шкале спектроскопа они видели спектр Солнца с темной линией D на своем обычном месте. Темная линия по-прежнему оставалась на месте и в том случае, когда исследователи ставили на пути луча горящую спиртовку. Но когда на пути солнечного луча они ставили экран и освещали призму только светом спиртовки, то на месте темной линии D четко проявлялась яркая желтая линия D натрия. Кирхгоф и Бунзен убирали экран — линия D вновь становилась темной.
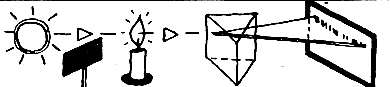
Опыт
Потом они луч Солнца заменяли светом от раскаленного тела — результат был всегда тот же: на месте ярко-желтой линии возникала темная. То есть всегда пламя спиртовки поглощало те лучи, которые оно само испускало.
Чтобы понять, почему это событие взволновало двух профессоров, проследим за их рассуждениями.
Ярко-желтая линия D в спектре пламени спиртовки возникает в присутствии натрия.
В спектре Солнца на этом же месте находится темная линия неизвестной природы.
Спектр луча от любого раскаленного тела — сплошной, и в нем нет темных линий. Однако если пропустите такой луч через пламя спиртовки, то его спектр ничем не отличается от спектра Солнца — в нем также присутствует темная линия и на том же самом месте. Но природу этой темной линии мы уже почти знаем во всяком случае, мы можем догадываться, что она принадлежит натрию.
Следовательно, в зависимости от условий наблюдения линия D натрия может быть либо ярко-желтой, либо темной на желтом фоне. Но в обоих случаях присутствие этой линии (все равно какой — желтой или темной!) означает, что в пламени спиртовки есть натрий.
А поскольку такая линия спектра пламени спиртовки в проходящем свете совпадает с темной линией D в спектре Солнца, то, значит, и на Солнце есть натрий. Причем он находится в газовом внешнем облаке, которое освещено изнутри раскаленным ядром Солнца.
Короткая заметка (всего две страницы), которую написал Кирхгоф в 1859 году, содержала сразу четыре открытия:
у каждого элемента есть свой линейчатый спектр, то есть строго определенный набор линий;
эти линии можно использовать для анализа состава веществ не только на Земле, но и на звездах;
Солнце состоит из горячего ядра и сравнительно холодной атмосферы раскаленных газов;
на Солнце есть натрий.
Первые три открытия были вскоре подтверждены, в том числе и гипотеза о строении Солнца: экспедиция, которую Французская академия наук в 1868 году во главе с астрономом Жансеном послала в Индию, обнаружила, что при полном солнечном затмении — в тот момент, когда его раскаленное ядро закрыто тенью Луны и светит только корона, — все темные линии в спектре Солнца вспыхивают ярким светом.
Вторую гипотезу сами Киргхоф и Бунзен уже в следующем году не только подтвердили, но и воспользовались ею для открытия двух новых элементов: рубидия и цезия.
В дальнейшем из этого скромного наблюдения над желтой двойной D-линией натрия родился спектральный анализ, с помощью которого мы теперь можем узнавать химический состав далеких галактик, измерять температуру и скорость вращения звезд и многое другое.

Наюлюдение
Все это действительно интересно, но сейчас нам важно понять главное: что дали открытия Кирхгофа и Бунзена для науки об атоме и какова их связь с нашими прежними знаниями о нем?
Мы знаем теперь два вида спектров: сплошной (или тепловой) и линейчатый.
Тепловой спектр содержит все длины волн, излучается он при нагревании твердых тел и не зависит от их природы.
Линейчатый спектр состоит из набора отдельных резких линий, возникает при нагревании газов и паров (когда малы взаимодействия между атомами), и — что особенно важно - этот набор линий неповторим для любого элемента. Более того, линейчатые спектры элементов не зависят от вида химических соединений, составленных из этих элементов. Следовательно, их причину надо искать в свойствах атомов.
То, что элементы однозначно и вполне определяются видом линейчатого спектра, вскоре признали все: но то, что этот же спектр характеризует отдельный атом, осознали не сразу, а лишь в 1874 году благодаря работам знаменитого английского астрофизика Нормана Локьера (1836—1920) А когда осознали, сразу же пришли к неизбежному выводу: поскольку линейчатый спектр возникает внутри отдельного атома, то атом должен иметь структуру, то есть иметь составные части!
АТОМЫ
В 1865 году, когда появились работы Йозефа Лошмидта, об атомах знали немного: их представляли себе твердыми шариками размером примерно 10-8 см и весом от 10-24 до 10-22 г. Каждому такому «шарику» можно приписать «атомный вес» — число, которое показывает, во сколько раз он тяжелее атома водорода. Например атомный вес кислорода равен 16, а гелия — 4. Отсюда просто заключить, что в 1 г водорода, в 4 г гелия или в 16 г кислорода (или, как принято говорить в химии, в одном грамм-атоме любого вещества) содержится одинаковое число атомов водорода гелия кислорода. Это число N = 6,02-10 • 23 — число Авогадро — мы уже однажды приводили.
Йозеф Лошмидт
Представлений об атомах — твердых шариках — было достаточно для объяснения многочисленных фактов из химии, теории теплоты и строения материи. Однако уже к 1870 году вполне оформилась мысль, что атом состоит из еще более простых частиц, и физики принялись их искать. Прежде всего они стали исследовать электрические свойства атома.
Все вещества, как правило, электрически нейтральны. Однако при некоторых условиях они обнаруживают электрические свойства, например, если натирать стекло шерстью, янтарь — шелком и тому подобное. Особенно отчетливо они проявляются в явлениях электролиза.
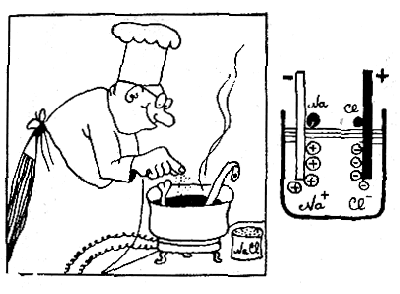
Если в расплав какой-либо соли (скажем, поваренной — NaCl) опустить два электрода и подключить их к полюсам батареи, то в расплаве произойдут изменения: на катоде (электрод, который подключен к отрицательному полюсу батареи) начнет выделяться чистый металл натрий, на аноде — газ хлор. Это означает, что в расплаве атомы натрия заряжены положительно, а атомы хлора — отрицательно, и поэтому под действием электрического поля они двигаются в противоположных направлениях.
Майкл Фарадей (1791—1867) в 1834 году установил количественные законы этого явления. Оказалось, что если через растворы различных веществ, молекулы которых построены из одновалентных атомов, пропускать одно и то же количество электричества, равное 96521 кулону, то на электродах всегда выделяется ровно по одному грамм-атому вещества. Например, из расплава поваренной соли выделится 23 г металла натрия и 37,5 г газа хлора.
Закон электролиза Фарадея легко понять, если предположить, что в расплаве NaClc каждым атомом связан определенный заряд, причем для ионов Na+ и С1- эти заряды равны и противоположны по знаку. (Название ион — «странник» — таким «заряженным» атомам дал Фарадей.) Заряд, который переносит один ион, равен е = 4,802 • 10-10 CGSE (электростатических единиц электричества).
Это значение очень мало, но мы уже немного привыкли к таким малым величинам. Более удивительно другое: заряда, меньшего, чем этот элементарный заряд е, обнаружить не удалось. С легкой руки Джонстона Стонея (1826—1911) в 1891 году это наименьшее количество заряда получило название «электрон».
ЭЛЕКТРОНЫ
Первоначально с этим словом не связывали понятия о частице. Оно служило лишь для обозначения того наименьшего количества заряда, которое может переносить с собой ион любого атома. Однако подспудно мысль о том, что электрон — частица, всегда жила. Действительно, проследите мысленно процесс электролиза: вот ион натрия (Na+), двигаясь в растворе под действием электрического поля, подходит к катоду; на катоде избыток отрицательных зарядов, поэтому в момент, когда ион Na+ его касается, он забирает от катода один отрицательный заряд и, не меняя веса, выделяется в виде нейтрального атома натрия.
Попробуйте теперь вообразить сам момент перехода отрицательного заряда от катода к иону Na+: что добавляется к иону, когда он, не меняя веса, становится нейтральным?
Представить себе этот процесс довольно трудно, если не предполагать при этом, что элементарный заряд может существовать и вне атома. Эту трудность сознавали, конечно, все, но признать атомарное строение электричества было еще труднее, ибо при этом рушились удобные и привычные представления об электричестве как о некоем тонком флюиде, который без труда проникает во все тела.
В 1881 году на собрании Лондонского химического общества, посвященном чествованию памяти Майкла Фарадея, Герман Людвиг Фердинанд фон Гельмгольц (1821—1894) прочел доклад «Современное развитие взгляда Фарадея на электричество». В этом докладе Гельмгольц впервые отчетливо сформулировал мысль о «молекулярном строении электричества». Конечно, сама по себе эта мысль даже в то время не была новой.
Еще в 1749 году великий американец Бенджамен Франклин подозревал нечто похожее, но тогда его догадка ни на чем, в сущности, не была основана, а потому и не привела к новым - следствиям. В 1871 году к мысли Франклина возвратился немецкий физик Вильгельм Эдуард Вебер (1804—1891), но сочувствия не встретил: в его время об электричестве знали уже так много, что на веру гипотез не принимали — знание предполагает ответственность. Нужны были экспериментальные доказательства идеи об электроне. Их стал Л искать в явлениях проводимости газов.

Бенджамен Франклин
Представьте себе стеклянную трубку, наполненную каким-либо газом (например, неоном) и запаянную с обоих концов вместе с проволочками (обычно - платиновыми). Если мы обе эти проволочки присоединим к разным полюсам батареи: одну к отрицательному (катоду), а другую — к положительному (аноду), то по цепи пойдет ток. Совершенно так же, как и в случае с электролитом. Вероятно, именно эта аналогия с явлениями электролиза и побудила в свое время (в 1838 году) Майкла Фарадея построить прообраз такой трубки («электрическое яйцо» Фарадея). Как мы увидим позже, аналогия была чисто внешней, но и само по себе явление проводимости газов было настолько интересным, что многие исследователи посвятили жизнь изучению его свойств.
Примерно в середине прошлого века Юлиус Плюккер (1801 — 1868)(это имя знакомо теперь каждому математику) оставил свои занятия геометрией, которые не нашли признания среди современников, и увлекся опытной физикой. Когда вы следите за игрой световых реклам, вы обязаны этим зрелищем профессору математики в Берлине и Бонне. Именно Плюккер в 1858,году изобрел эти светящиеся трубки. (Обычно их называли Гейслеровыми, по имени знаменитого стеклодува Генриха Гейслера, который был техническим ассистентом Плюккера и научился особенно искусно их изготовлять; а еще полвека спустя их повсеместно называли трубками Крукса).
Прежде всего Плюккер установил, что проводимость газа зависит от его концентрации в трубке и возрастает, если часть газа из трубки откачать. При этом каждый газ начинает светиться своим характерным цветом, так что по цвету свечения можно определить состав газа в трубке. (К этому выводу Плюккер пришел даже раньше Кирхгофа и Бунзена, но не понял его значения.) Если увеличивать разрежение в трубке, то вблизи катода появляется темное пространство («катодное пятно»), которое при дальнейшем откачивании газа из трубки расширяется и наконец заполняет ее всю: трубка перестает светиться. Но это темное пространство живет, его пронизывают какие-то «лучи», хоть и невидимые для глаза (как невидима летящая пуля, пока не встретит препятствия на своем пути).
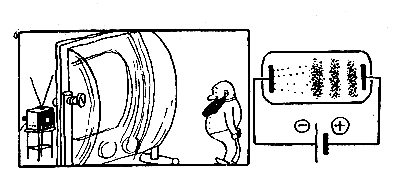
Плюккер
Ученик Плюккера Евгений Гольдштейн (1850— 1931) в 1876 году дал им название: катодные лучи. Еще раньше, в 1869 году, другой его ученик, Иоганн Вильгельм Гитторф (1824—1914), обнаружил отклонение этих лучей в магнитном поле, и наконец в 1879 году Кромвель Вэрли (1828—1883) показал, что они заряжены отрицательно.
Поставьте себя на место этих исследователей: 70-е годы XIX столетия, у вас в руках набор интересных фактов, однако связи между ними не видно. С одной стороны, явление проводимости газов очень напоминает процессы электролиза, но, с другой стороны, происходят вещи совсем непонятные: например, проводимость растет с уменьшением концентрации газа в трубке. Кроме того, обнаружен только поток отрицательных «лучей» и не обнаружено положительных.
Нужна была руководящая идея.
Такая идея возникла после блестящих опытов, которые поставил Уильям Крукс — английский физик и химик. Это был интересный человек, наделенный к тому же редким даром — предвидеть фундаментальные открытия. Крукс нигде не служил и всецело был предан науке (что не помешало ему, однако, верить в спиритизм и в 1913 году стать президентом Королевского общества).
Прежде всего, он гораздо сильнее откачал воздух из трубки. При этом от катода отделилось еще одно, более темное пространство, которое также постепенно заполнило всю трубку, после чего анод вспыхнул зеленоватым светом. Тот день 1878 года, когда это произошло, можно считать днем рождения электроннолучевой трубки — основной части современного телевизора. Уже за одно это Круксу обеспечено признание потомков. Но для самого Крукса это было только началом — он стал тщательно изучать свойства излучения, которое он называл лучистой материей (этот термин ввел все тот же Фарадей еще в 1816 году). Крукс чувствовал, что столкнулся с совершенно новым явлением природы, и предлагал назвать его «четвертым состоянием вещества», которое «ни жидко, ни твердо, ни газообразно». Он писал:
«Изучая четвертое, лучистое состояние материи, мы, как мне кажется, имеем под руками и в сфере нашим исследований те первичные атомы материи, из которых, как вполне основательно предполагают, состоят все тела природы. Мы видим, что лучистая материя! по одним своим свойствам так же материальна, как вот этот стол, по другим — она скорее похожа на лучистую энергию. Мы действительно коснулись той пограничной области, где материя и энергия переходят друг в друга. Я думаю, что величайшие задачи будущего, найдут свое разрешение именно в этой пограничной! области; более того, здесь, как мне кажется, лежит граница всего реального мира».
Чтобы оценить смелость Крукса, надо вспомнить, что в то время весь мир разделяли на материю и эфир, причем две эти его части считали противоположными и несовместимыми: с материей отождествляли частицы, а с эфиром — среду, колебания которой мы воспринимаем как лучи света.
Таким образом, лучистая материя Крукса должна была совмещать в себе свойства несовместимые: луча и частицы. Через полстолетие все могли убедиться, на сколько он был прав, но в то время (по словам Оливеpa Лоджа — современника и соотечественника Крукса) «...предположение Крукса имело судьбу тех проблесков мысли, которые иногда разрешаются авторам, но подвергаются насмешкам со стороны ортодоксальной науки их времени».
Независимо от смысла, который Крукс вкладывал в понятие «лучистая материя», он бесспорными опытами обнаружил у нее такие свойства: она распространяется прямолинейно; вызывает свечение тел и может их даже расплавить; отклоняется в электрическом и магнитном полях; проникает сквозь твердые тела, а в воздухе проходит путь 7 см, в то время как атомы — только 0,002 см.
Опираясь на эти факты, Уильям Крукс утверждал: катодные лучи, или лучистая материя, есть поток быстрых отрицательных частиц, величина которых значительно меньше размеров атомов.
Легко убедиться, что высказанная гипотеза проясняла все свойства катодных лучей. В частности, ею можно легко объяснить появление темного пространства у катода: его величина определялась просто средним расстоянием, которое пролетают электроны, не сталкиваясь с атомами газа. Очевидно, это расстояние растет по мере выкачивания газа из трубки. Но главное значение гипотезы в другом: именно она стала той руководящей идеей, которая позволила почувствовать себя устойчиво в море фактов, накопленных к тому времени.
Физики знали теперь, куда идти и что искать: необходимо было выделить «атом электричества» и определить его свойства: заряд, массу и размеры.
На это понадобилось почти 20 лет и усилия таких больших физиков, как Джозеф Джон Томсон (1856—1940), Джон Таунсенд (1868—1957), Вильгельм Вин (1864—1928), Джордж Фитцжеральд (1851—1901), Эмиль Вихерт (1861—1928), Жан Перрен (1870—1942), Роберт Эндрюс Милликен (1868—1953). У нас нет возможности рассказать сейчас об остроумии и тонкости опытов, которые придумали эти и многие другие ученые. Поэтому проследим просто, как гипотетический «атом электричества» обретал постепенно реальные свойства, пока не стал, наконец, основой физики.
Прежде всего Жан Перрен в 1895 году окончательно доказал: заряд катодных лучей отрицателен. В течение последующих двух лет выяснили: их скорость равна примерно одной десятой скорости света, то есть примерно в 10000 раз больше скорости ружейной пули и скорости теплового движения атомов. Кроме того, эти и все остальные свойства лучей не зависят от состава газа в трубке. А это означало, что катодные частицы — непременная составная часть всех атомов.
И наконец, в 1897 году Дж. Дж. Томсону удалось определить заряд е и массу m отдельного «атома электричества».
Оказалось, что масса этих частиц (≈10-27 г) примерно в тысячу раз меньше массы атома водорода, а заряд (е ≈ 5•10-10 CGSE) почти точно равнялся тому заряду иона водорода, который был измерен при изучении электролиза.
Это было неожиданно. Посудите сами: явления электролиза и проводимости газов изучали разные науки, которые развивались независимо друг от друга, и в них на протяжении десятилетий сформировались свои понятия. И вдруг они оказались тесно связанными. «Такие факты в истории науки, — говорил ученик Планка нобелевский лауреат Макс Лауэ, — самое сильное доказательство ее истинности». Для физиков такие события всегда праздник, и мы еще посетим подобные перекрестки науки.
История электрона — хороший способ усвоить логику открытий нынешней физики: исходя из наблюдений, ученые выдвигают на их основе гипотезы, которые вновь проверяют опытом, и, наконец, этот процесс завершается теорией, то есть сжатым, объяснением частных явлений на основе немногих общих принципов. Гипотеза об электроне возникла из наблюдений Фарадея, Плюккера и Крукса. Плодотворность ее была проверена и доказана в опытах Дж. Дж. Томсона и других физиков.
И наконец, Гендрик Антон Лоренц (1853—1928) настолько поверил в реальность электрона, что создал на основе этой гипотезы теорию, следствия из которой вновь можно было проверить.
Процесс этот беспределен, но это единственный способ движения науки.
Возвратимся, однако, в 1897 год, когда после сорокалетних усилий получила права гражданства первая «элементарная частица» — электрон. Это было самое важное событие в физике со времени признания реальности атома. В тот год узнали, что существуют частицы значительно меньше атомов, что они входят в состав всех атомов; что не только материя, но и электричество имеет атомистическую структуру. Все это означало, что в природе реально существует материальный носитель наименьшего заряда.
Как и атом, электрон признали далеко не сразу. Еще в 1902 году Оливер Лодж писал: «...электрон — это чисто гипотетический заряд, изолированный от атома». И даже в 1920 году великий Рентген запрещал сотрудникам своего института произносить это слово.
Сейчас эти сомнения трудно понять.
Физики, сразу поверившие в реальность электронов, тщательно измеряли его характеристики: заряд е и массу m. Благодаря их трудам (особенно трудам Роберта Милликена, который с 1909 по 1940 год периодически возвращался к этой задаче) мы сейчас знаем эти числа с большой точностью: m = 9,1083•10-28 г, е=4,80274•10-10 CGSE.
А размер? Каковы размеры электрона? Увы, нам это неизвестно до сих пор. Мы не знаем даже, имеет ли вообще этот вопрос четкий смысл. В самом деле, о свойствах электрона мы узнаём, изучая его взаимодействия с другими частицами и полями. Но для понимания результатов всех этих опытов нам достаточно знать только массу и заряд электрона и совершенно ни к чему знать его размеры. Не исключено, что такого свойства у электронов и вправду нет. Ведь нельзя же указать толщину экватора, хотя длину его измерить можно. Или, быть может, величина электрона зависит от условий опыта? Такую возможность тоже нельзя отрицать заранее; ведь изменяет же комета свои размеры, приближаясь к Солнцу, хотя масса ее при этом остается постоянной. Все это не праздные вопросы и мы к ним еще возвратимся.
АТОМЫ, ЭЛЕКТРОНЫ, ЛУЧИ
Мы только что повторили тот сложный участок пути, который прошли исследователи в конце прошлого столетия. Это было время, когда обилие новых явлений заслоняло простые связи между ними. Когда нужна была большая вера в гармонию природы, чтобы не потеряться в хаосе пестрых фактов и разноречивых гипотез.
Истино великое открытие не только отвечает на старые вопросы, но и порождает новые. Открытие электрона вызвало воодушевление физиков. Однако вскоре на смену ему пришли новые заботы. Как электроны связаны в атоме? Сколько их там? Покоятся они или движутся? И как их движения связаны с излучением атомов?

Открытие электрона
Форма и характер вопросов менялись, но постепенно все они свелись к задаче: необходимо узнать число, размеры и расположение электронов, в атоме, а также их влияние на процессы излучения.
Никто при этом не задумывался, имеют ли вообще 1 такие вопросы смысл. В то время все молчаливо представляли себе электрон маленьким шариком диаметром 10-13 см, который «как-то» закреплен внутри атома.
Для начала хотели понять главное: почему атом излучает спектральные линии строго определенной длины волны и почему этих линий так много (у атома железа, например, только в видимой части спектра свыше 3000). Как всегда, если нет глубоких идей, мыслили аналогиями. Все хорошо помнили, что частота колебаний пружины с грузиком зависит от ее упругости, следовательно, рассуждала часть физиков, и в атоме электроны связаны «какими-то» пружинами различной упругости. Когда мы возбуждаем атом, электроны начинают колебаться и при этом излучают свет с частотой колебания пружинок. Отсюда, по мысли Локьера, сразу следовало, что число электронов в атоме равно числу линий в спектре элемента. Кроме того, атом с подобным устройством будет наиболее охотно поглощать именно те лучи, которые он сам испускает. Но ведь именно это и обнаружили Кирхгоф и Бунзен в своем знаменитом опыте с парами натрия!
Несмотря на успехи модели атома с упругосвязанным электроном, многие понимали ее логическое, или, точнее, эстетическое, несовершенство. А вскоре обнаружили и прямые противоречия с опытом. Дж. Дж. Томсон, изучая рассеяние рентгеновых лучей на атомах различных элементов, пришел к выводу, что число электронов в атоме сравнительно невелико и примерно равно половине атомного веса элемента. В 1904 году он предложил свою модель атома, развив гипотезу однофамильца Уильяма Томсона (лорда Кельвина): внутри положительного равномерно заряженного атома-шара диаметром 10-8 см плавают отрицательные электроны, квазиупруго с ним связанные. Число электронов равно заряду шара, так что в целом атом оказывается нейтральным, как это и должно быть.
В начале нашего века почти все физики приняли модель Томсона, и лишь немногие из них предлагали другие модели. Но,. несмотря на частные разногласия, все чувствовали: в науке об атоме наступает новая эпоха.
ВОКРУГ КВАНТА
УИЛЬЯМ КРУКС (1832—1919)
Родился У. Крукс в семье торговца на Риджен-стрит в Лондоне. Был он старшим из 16 детей от второго брака, и было еще 5 детей от первого. Как он сам говорил, в его семье вряд ли знали слово «наука», и первоначальное образование он получил у дяди, книжная лавка которого находилась рядом с магазином отца.
В 19 лет он оканчивает только что открытый Королевский химический колледж и работает ассистентом в том же колледже. Одновременно он посещает в Королевском институте лекции Фарадея, которые произвели на него незабываемое впечатление.
В 1861 году он открыл элемент таллий, а в 1869 году его избрали членом Королевского общества, где 30 ноября 1878 года он докладывал его членам о свойствах катодных лучей.
Ходит упорный слух, что он был близок к открытию рентгеновых лучей. Дело в том, что во время экспериментов с катодными лучами он постоянно обвинял компанию Ильфорда в том, что она поставляет ему засвеченные фотопластинки. (Как мы теперь понимаем, рентгеновы лучи, возникающие при столкновении электронов со стенками трубки, вполне могли засветить фотопластинки даже в закрытой коробке.) Слух не подтвержден, во всяком случае сам Крукс об этом нигде не упоминал публично.
Крукс был удивительно богатой натурой: изобретатель, издатель журнала «Химические новости» и чистый исследователь в одно и то же время. Человек он был приветливый, уравновешенный, преданный своей семье и осмотрительный с людьми посторонними.
«Это был исключительно независимый, оригинальный и мужественный ум, он смотрел на явления по-своему и не боялся высказывать мнения, в корне отличные от утверждений всех прежних ортодоксов», — говорил о нем впоследствии Дж. Дж. Томсон.
КИНЕТИЧЕСКАЯ ТЕОРИЯ ГАЗОВ
Вместе с учеными XIX века мы стремимся сейчас проникнуть в глубь атома. Но наряду с этими попытками в том же XIX веке пробовали объяснить физические свойства тел, не входя в детали внутреннего строения атомов. Мысль, лежащая в основе этих попыток, предельно проста: атомы, из которых состоят все вещества в природе, не покоятся, а находятся в постоянном движении.
Оказалось, что подобное представление приводит к большому числу следствий, если сформулировать его на языке математики. А такие попытки, начиная с Ньютона, который хотел математически объяснить газовый закон Бойля — Мариотта, неоднократно предпринимались. Однако создателем кинетической теории материи следует считать Даниила Бернулли (1700—1782).
Он родился в семье выходцев из Голландии, в семье, которая дала миру более 120 выдающихся и знаменитых ученых, артистов, литераторов и государственных Деятелей. Вопреки воле отца Даниил обучался математике у своего старшего брата Николая и затем закончил образование в Италии. В 1725 году вместе с Николаем он едет в Петербург, куда петровские реформы привлекли многих иностранцев. Спустя восемь месяцев Николай умирает. Даниил — к тому времени уже профессор математики — прожил в Петербурге еще семь долгих лет, до тех пор, пока смог переносить русский климат и образ жизни. Здесь он написал свою «Гидродинамику», которую напечатал через пять лет после возвращения, в 1738 году, в Базеле.
Примерно в то же время, и в том же Петербурге сходные мысли развивал Михаил Васильевич Ломоносов.
Кинетическую теорию газов постигла странная судьба. «Гидродинамику» Бернулли не заметили и обнаружили ее только спустя 120 лет, в 1859 году. А работы Ломоносова, написанные в 1742—1747 годах, стали известны лишь в 1904 году.
В XIX веке произошло второе рождение кинетической теории газов, поначалу тоже неудачное. В 1821 году Джон Херэпет (1790—1868) — темпераментный и любящий споры школьный учитель из Бристоля — высказывает вновь кинетическую гипотезу, но ее опять оставляют без внимания. Четверть века спустя, в 1845 году, морской инструктор Ост-Индской компании в Бомбее Джон Джеймс Уотерстон (1811 —1883) прислал в Лондон в Королевское общество обширный трактат по кинетической теории газов. Это сочинение не напечатали, поскольку рецензенты оценили его как «...нелепость, негодную даже для чтения перед Королевским обществом». Только в 1892 году лорд Рэлей отыскал рукопись Уотерстона в архивах и опубликовал ее.
Причину такого единодушного забвения этих трудов следует искать в общем умонастроении физиков того времени. Отчасти тому виной были тогдашние философские учения: в середине XIX века почти все философы отрицали существование атомов.
Тем не менее идеи Херэпета и Уотерстона не погибли: они решающим образом повлияли на работы Джеймса Прескотта Джоуля (1818 — 1889), который в 1851 году впервые оценил скорость молекул газа. Она оказалась неожиданно большой: например, для молекул водорода она равна примерно 1800 м в секунду — вдвое больше скорости артиллерийского снаряда.
В дальнейшем развитие кинетической теории материи пошло быстро: ее переоткрыли Крониг (1856) и Клаузиус (1857) и развили почти до современного состояния Максвелл (1860) и Больцман (1880). С тех пор это одна из основных наук о строении материи, с помощью которой объяснили теплоемкость и теплопроводность твердых тел, упругость и вязкость газов и многое другое.
МИХАИЛ ВАСИЛЬЕВИЧ ЛОМОНОСОВ
По вполне понятным причинам особо следует отметить вклад в науку об атомах и их движении, сделанный Ломоносовым. В 1742 году в диссертации «О составляющих тела природы нечувствительных физических частичках, в которых находится достаточное основание частичных свойств» он писал:
«...§ 87. Аксиома. Сложные тела состоят из некоторого числа составных частей, на которые они распадаются...
§ 89. Теорема 10. Все тела состоят из нечувствительных физических частичек, заключающих в себе основание частичных качеств, которые при движении не могут разделиться на другие, меньшие...
§ 90. Изъяснение. Мы называем физическими монадами нечувствительные физические частички, не разделяющиеся на другие, меньшие, при движении Мы не оспариваем возможность мысленно делить материю до бесконечности, но полагаем возможным, не опасаясь ошибки, обойтись без этого в физических делах. Также не заботимся мы и о рассеянной по материи пустоте (если она существует); с ней ведь не связано никакого понятия, кроме протяжения, поэтому она никаких свойств не имеет и ничего посему не может дать сущности и природе вещей, независимо от того, существует ли она, или нет.
§ 91. Теорема 11. Фигура физических монад неизменна...»
Причину тепла и холода Ломоносов видел «во взаимном движении нечувствительных физических частичек». В 1744 году он представил Академии наук диссертацию «Размышления о причине тепла и холода», представление о которой дают несколько выдержек из нее:
«§ 1. Весьма известно, что тепло возбуждается движением: руки от взаимного трения согреваются, дерево загорается, искры вылетают при ударе кремнем о сталь, железо накаливается при ковании его частыми, сильными ударами...
Из всего этого совершенно очевидно, что имеется достаточное основание теплоты в движении. А так как никакое движение без материи происходить не может, то необходимо, чтобы достаточное основание теплоты состояло в движении какой-либо материи...
§ 6. Внутреннее движение можно себе представить происходящим трояко: 1) или нечувствительные частички тела постоянно меняют свое место; 2) или в одном месте постоянно вращаются; 3) или, наконец, в нечувствительном пространстве в нечувствительное время постоянно колеблются взад и вперед. Первое называем поступательным, второе — коловратным, третье — колебательным...
§ 13. Из этой нашей теории вытекают такие следствия: 1) наиболее приспособленными к нашему тепловому движению являются шарообразные корпускулы вещества... 2) как каждое движение в смысле количества может увеличиваться и уменьшаться, так же следует себе представить и тепловое движение... 3) частички теплых тел должны вращаться скорее, более холодных — медленнее».
В протоколах академии об этой работе сохранился отзыв, в котором сказано, что «адъюнкт Ломоносов слишком рано принялся за сочинение диссертаций». Низкая культура тогдашней академии и прогрессирующая в дальнейшем изоляция России привели к тому, что научные труды Ломоносова не оказали влияния на последующее развитие науки. Они были забыты, и в памяти потомков в течение полутора столетий он остался только поэтом. Лишь позже, к двухсотлетию со дня его рождения, постепенно извлекли из архивов научные труды Ломоносова и поняли величие этого воистину российского таланта.
|
ПОИСК:
|