
ГЛАВА ДЕВЯТАЯ
Уравнение Шредингера - Форму чего изображает ψ-функция - Атом - Квантовая истина
«Может быть, естествоиспытателя, покидающего область непосредственных чувственных восприятий с целью открытия более общих взаимосвязей, можно сравнить с альпинистом, который хочет подняться на вершину самой высокой горы для того, чтобы обозреть лежащую перед ним местность во всем ее многообразии. Альпинисту тоже необходимо покинуть плодородные населенные долины. По мере того как он поднимается, перед ним все шире и шире раскрывается окрестность, но вместе с тем все реже он видит вокруг себя признаки жизни. Наконец, он попадает в ослепительно яркую область льда и снега, где уже нет никакой жизни и дышать становится почти невозможно. Только пройдя эту область, он может достигнуть вершины. Но когда он взойдет на вершину, наступит момент, что вся расстилающаяся перед ним местность станет ему видна совершенно отчетливо, и, может быть, тогда область жизни не будет слишком далека от него... В предшествующие эпохи эти безжизненные области воспринимались только как суровые пустыни, вторжение в которые казалось кощунством по отношению к каким-то высшим силам, жестоко каравшим всех тех, кто осмеливался приблизиться к ним».
Глава девятая
Эти слова Гейзенберга хорошо поясняют тот качественный скачок, который произошел в сознании людей, когда они перешли от наблюдения явлений, непосредственно воздействующих на их органы чувств, к изучению атомных явлений. Этот перелом произошел в начале века, и он настолько важен, что мы еще раз поясним его на конкретном примере.
Представьте, что перед вами звучит натянутая струна. Вы слышите звук, видите вибрирующую струну, можете прикоснуться к ней рукой, и на основании этих данных в сознании у вас формируется образ физического явления, происходящего перед вами. Понятие «волновой процесс» возникает позднее, при наблюдении других, похожих явлений. Чтобы сделать это понятие однозначным, его закрепляют формулой, уравнением, позволяющим заранее предсказать весь процесс колебания струны. Это предсказание мы можем проверить, запечатлев, например, колебания струны на кинопленке...
Мы сознательно еще раз проследили цепочку:
явление -> образ -> понятие -> формула -> опыт,
которая лежит в основе всего физического знания. Последнее звено в этой цепи — опыт проверяет, насколько правильно мы представляем себе явление в целом на основе частичных знаний о нем.
Последнее звено цепочки опытов
Но эта простая схема не поможет нам ответить на вопрос «Что такое атом?» просто потому, что явление «атом» не воздействует на наши органы чувств, и они не могут дать нам никакого, даже приблизительного, «образа атома». Поэтому вначале понятие «атом» возникло чисто умозрительно, без ссылок на органы чувств и в течение двадцати веков оставалось не более чем любопытной гипотезой, которая ничем не лучше других гипотез о строении материи.
Настоящая история атома началась с приходом науки, когда люди стали полагаться не только на свои органы чувств, но научились также доверять показаниям приборов. С помощью приборов они наблюдали, как ведут себя тела при растворении, при пропускании через раствор электрического тока, при нагревании, при освещении и при многих других воздействиях. Ученые не просто наблюдали эти явления, но изучали их, то есть измеряли температуру тел, длину волны излучаемого ими света и многое другое, о чем мы уже знаем. Результаты своих измерений они записывали в виде чисел, Вот эти-то числа и заменили физикам те непосредственные ощущения, которые доставляли им ранее органы чувств. Числа — вот единственное, чему они стали доверять, когда стали изучать явления, недоступные непосредственному восприятию. Имея в руках числа, они стали находить между ними связи и записывать эти связи в виде формул.
Но люди общаются не с помощью формул, а с помощью слов, и, чтобы рассказать о новых связях в природе, они придумывают понятия, которые соответствуют формулам. Иногда эти понятия очень необычны, но люди к ним быстро привыкают, учатся правильно пользоваться ими и даже создают для себя какие-то образы, которые они связывают с новыми понятиями.
Цепочка познания переворачивается:
явление образ <- понятие <- формула <- опыт. |________________________________________^
В истории атома эту цепочку можно легко проследить: Фраунгофер, Кирхгоф и Бунзен обнаружили, что каждый атом испускает строго определенный набор спектральных линий (явление) и каждой спектральной линии соответствует число — длина волны λ, (опыт). Бальмер, Ридберг и Ритц нашли между этими числами простые связи (формула), а Бор показал, что их формулы следуют из единого принципа, который назвали квантованием (понятие). Наконец на основе этих опытов, формул и понятий возник образ — атом Бора.
Но опыты продолжались, они приносили новые числа и факты, которые уже не вмещались в рамки прежних формул, понятий и образов. И тогда возникла квантовая механика — единый принцип, из которого следовали все прежние эмпирические формулы и удачные догадки.
До сих пор мы довольно много узнали об опытах атомной физики и о понятиях, которые необходимо использовать, чтобы эти опыты объяснить. Но мы хотим большего: на этом новом, более высоком уровне знаний мы хотим создать >образ атома. Для этого нам нужно, хотя бы бегло, коснуться формул квантовой механики. Это необходимо — в конце концов красота логических построений в науке много важнее, чем эффекты неожиданных ассоциаций.
УРАВНЕНИЕ ШРЕДИНГЕРА
Предыдущие рассказы о квантовой механике почти убедили нас в том, что электрон в атоме не имеет определенного положения или хотя бы какой-нибудь орбиты, по которой он движется. Взамен этого мы пока что усвоили довольно туманную идею о том, что при движении в атоме электрон «расплывается».
Эту неопределенную идею Шредингеру удалось выразить весьма точно на однозначном языке формул. Уравнение Шредингера, как и всякий глубокий закон природы, нельзя вывести строго из более простых. Его можно только угадать. Шредингер так и сделал, и впоследствии признавался, что сам не вполне понимает, как это ему удалось. Но после того как уравнение угадано, надо еще научиться им пользоваться: надо знать, что означают все символы в уравнении и какие явления в атоме они отображают.
Уравнение Шредингера
[(d2 ψ)/(dx2) + 2m/ħ2][E - U(x)(x)]ψ = 0
мы уже приводили однажды и объясняли смысл входящих в него символов: ħ - постоянная Планка h, деленная на 2π m — масса электрона, Е — полная энергия электрона в атоме a U(х) — его потенциальная энергия, которая показывает, с какой силой притягивался бы электрон к ядру, если бы он был частицей и находился от него на расстоянии х. Но нам по-прежнему неясен смысл волновой функции пси (ψ). Чтобы ронять его, обратимся снова к аналогии с колеблющейся струной.

Уравнение Шредингера
Ее уравнение
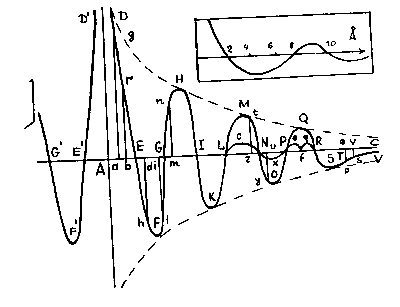
[(d2U)/(dx2)] + [2π/λ]2U = 0
очень похоже на уравнение Шредингера. Несколько решений уравнения струны, функции U = Uk(x), изображено на рисунке. Это обычные, знакомые всем синусоиды, и смысл их очевиден: они изображают форму струны в какой-то момент времени, то есть моментальную фотографию процесса ее колебания. Форма колебаний струны зависит от числа узлов k — точек, остающихся неподвижными в процессе колебания. Поэтому существует бесконечно много решений U=Uk(x), которые различаются между собой числом узлов k.
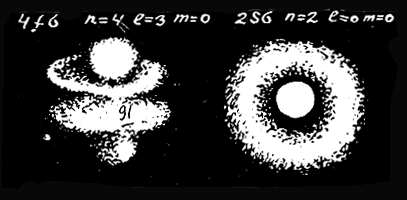
Теперь взгляните на рисунок, где рядом с синусоидами струны Uk((x) изображены решения ψ = ψn(x) уравнения Шредингера для атома водорода. Они очень похожи. И если даже никаких реальных колебаний, подобных движениям струны, в атоме не происходит, то аналогия не становится от этого менее полезной.
Отмеченная аналогия позволяет пронумеровать решения ψn(x) целым числом n точно так же, как решения Uk(x) нумеруются целым числом к. Более того, оказалось, что целое число n — это и есть то самое непонятное квантовое число, которым Бор нумеровал орбиты электрона в атоме. Теперь оно потеряло свой мистический оттеннок: n — не что иное, как число узлов волновой функции, увеличенное на единицу (n = k + l).
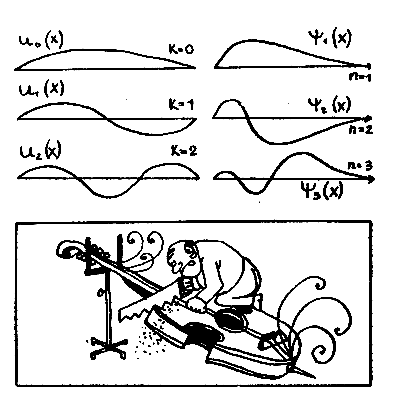
Струны
Первый постулат Бора неким «усилием воли» предписывал электронам двигаться только по тем орбитам в атоме, которые удовлетворяют квантовому условию:
m v; к = n(h/2π)
Это был плодотворный, но неестественный для физики принцип, и потому он вызвал у современников сложную смесь восхищения и недовольства. Требование Шредингера значительно естественнее: как бы хитро ни двигался электрон в атоме, он должен все-таки находиться внутри атома. Поэтому ψ-функция, которая это движение «представляет», независимо от своей природы должна быть сосредоточена вблизи ядра. Это единственное граничное условие позволило вывести из уравнения Шредингера все: условия квантования Бора, энергию электрона на стационарных орбитах, смысл квантовых чисел.
В свое время эти следствия теории Шредингера покорили многих своей простотой. В уравнение Шредингера поверили и стали выяснять последнее: что представляет собой сама функция ψ.
И если функция Uk(x) изображает форму колеблющейся струны, то что изображает ψ?
ФОРМУ ЧЕГО ИЗОБРАЖАЕТ Ψ-ФУНКЦИЯ
Это один из самых сложных вопросов квантовой механики, на который даже сам Шредингер вначале ответил неправильно. Но его ответ так удобен и так близок к истине, что мы им на первых порах воспользуемся. Вот он.
Электрон в атоме не существует как частица. Он расплывается там в некое облако. Форма и плотность этого облака определяется волновой функцией Ψ(х), причем на расстоянии х от ядра плотность ρ(х) электронного облака равна квадрату этой функции:
ρn(x) = |ψn(x)|2 .
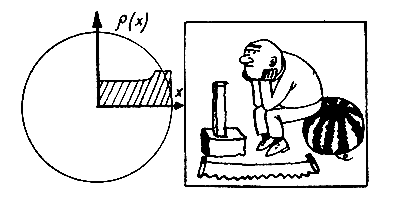
Плотность электронного облака
Чтобы пояснить эту мысль, вспомним тот самый арбуз, с которого мы когда-то начали рассказ о квантовой механике, и попытаемся на рисунке изобразить его плотность ρ(х) в зависимости от расстояния х до центра арбуза. Очевидно, что функция ρ(x) для арбуза везде примерно постоянна, она лишь несколько возрастает к краям из-за косточек и кожуры и, наконец, резко обрывается на границе арбуза. Взглянув на наш рисунок, человек, даже ни разу не видавший арбуза, может схематически представить себе, как устроен арбуз внутри. Правда, при этом он не будет иметь ни малейшего представления о его вкусе, цвете и аромате, а также о тысяче мелких признаков, которые отличают один арбуз от другого.
Пытаясь проникнуть внутрь атома, все мы оказываемся в положении человека, который никогда в жизни арбуза не видел, но хочет представить его себе по функции ρ(х). Для атома функцию ρ(х) вычисляют из уравнения Шредингера и затем с ее помощью рисуют распределение электронного облака в атоме. Эти картины заменяют нам тот зрительный образ атома, к которому все мы бессознательно стремимся.
На страницах 208 и 209 представлены объемные изображения атома водорода, построенные по функциям ρn(x), которые вычислены из уравнения Шредингера. Это и есть тот новый образ атома, к которому мы так долго шли и к которому теперь надо привыкать, В дальнейшем построенный образ изменится лишь немного — точнее, даже не сам он, а наше отношение к нему.
Теперь все самое сложное позади, и мы можем не торопясь подвести итоги. Прежде всего — и теперь уже на новом уровне — мы вновь обратимся к вопросу: «Что такое атом?»
АТОМ
Вспомните модель Томсона: большой положительный шар, и в нем плавают маленькие отрицательные электроны.
В действительности все оказалось наоборот: в центре атома расположено очень маленькое положительное ядро, окруженное отрицательным облаком электрона. Форма этого облака непроизвольна — она определяется строгими законами квантовой механики. Конечно, это не шарик с резкими границами, но в целом невозбужденный атом водорода очень похож на шар (его Демокрит угадал правильно).
Однако форма возбужденных атомов уже отличается от сферической и тем больше, чем сильнее возбужден атом.
Возбуждая атом, мы затрачиваем энергию как раз на перестройку его электронного облака. Каждой форме облака соответствует своя вполне определенная энергия. Поэтому, чтобы перевести атом из одной формы в другую, мы должны затратить строго отмеренное количество энергии — квант hν, как того и требовал второй постулат Бора.

Внутренняя энергия атома
До сих пор мы сознательно говорили только об атоме водорода. По существу, это единственный атом который физик знает сейчас во всех деталях и может представить себе его правдоподобный образ. Теперь это более или менее очевидно всем. Но в первые годы после создания квантовой механики энтузиазм Победителей был так велик, что они начисто забыли о прародительнице атома — химии. «С точки зрения физика химии не существует», — заявляли самые увлеченные из них. - Дайте нам заряд ядра, и мы оденем его шубой из электронов так, что этот построенный нами атом нельзя будет отличить от настоящего».
Химия
Начали строить — и оказалось, что без Химии обойтись не удается. Споткнулись уже на литии: вместо того чтобы расположить два электрона на первой оболочке, а третий — на второй, поместили все три его электрона на одну оболочку. Но в годы подъема такие частные затруднения быстро преодолеваются.
Выход нашли почти тотчас же, как только обратились к периодической системе элементов Менделеева, которая и прежде не раз выручала и физиков и химиков. В самом деле, если химические свойства веществ зависят от электронов, которые окружают ядро, то периодичность химических свойств элементов прямо указывает на то, что электроны в атомах расположены не как попало, а группами — оболочками. Вполне логично было предположить, что число электронов в каждой из оболочек совпадает с длиной периодов таблицы Менделеева. Вольфганг Паули так и сделал.
Лишь после этого удалось создать образ не только атома водорода, но и более сложных атомов. В целом форма электронного облака в тяжелых атомах не очень сильно отличается от наших рисунков. Но рассчитать ее точно удалось лишь после работ английского ученого Дугласа Хартри и советского физика Владимира Александровича Фока. Это очень сложная задача, которая не всегда по плечу даже современным вычислительным машинам, а тем более нам сейчас.
Говоря о форме тел, мы, как правило, предполагаем, что у них есть также и размеры. Однако это не всегда верно: у бильярдного шара есть и форма и размеры, но о размерах облака говорить уже трудно, хотя форма его обычно не вызывает сомнений.
Самое неожиданное следствие новой модели атома состоит в том, что атом не имеет определенных геометрических размеров. Иными словами, границу атома можно отметить лишь условно — точно так же, как и очертания облака. Мы вынуждены принять это следствие новой модели атома, чтобы объяснить наблюдаемые свойства тел, например разнообразие геометрических форм кристаллов. Нас не должно это особенно удивлять — ведь и дома построены из кирпичей, но нам не кажется странным, что кирпичи — это не дом в миниатюре, а просто кирпичи. У тел, окружающих нас, есть цвет, запах, есть размеры, но атомы, из которых построены эти тела, не обладают ни одним из этих качеств. У них осталось только одно неизменное свойство — масса. А неизменной формы нет. Неизменны лишь законы квантовой механики, которые управляют этой формой.
Но почему атом, у которого даже нет размеров, так устойчив? Нас не должно удивлять и это: в конце концов Земля тоже не стоит на трех китах, однако уже миллионы лет, повиснув в пустоте, сохраняет свою орбиту неизменной. Секрет ее устойчивости — в движении и в неизменности динамических законов, которые этим движением управляют. В этом же причина устойчивости атомов, хотя законы, управляющие движением электронов, совсем не похожи на законы небесной механики.
(Справедливости ради следует заметить, что квантовая устойчивость значительно надежнее, чем динамическая устойчивость классической механики: разрушенный атом восстанавливает свою структуру, но орбита Земли уже никогда не станет прежней, если однажды ее нарушит внезапное вмешательство инородного космического тела.)
Атомы различных элементов разнятся между собой массой и зарядом ядра. Но по какому признаку различить два атома одного и того же элемента? Для арбузов такой вопрос неактуален: никто никогда не видел двух совершенно одинаковых арбузов. Отличить один кирпич от другого уже много сложнее, и только в том случае, если кирпичи битые, задача немного упрощается.
Атомы различных элементов
С атомами дело обстоит точно так же. Если их массы и заряды ядер равны, то различаться атомы могут только формой электронного облака — других свойств у них просто нет; два атома можно различить лишь в том случае, если один из них возбужден. Все невозбужденные атомы одного и того же элемента неразличимы между собой, как кирпичи из одной формы. Роль такой формы для атомов играют динамические законы квантовой механики, неизменные и одинаковые для всех атомов.

Форма электронного облака 1
Портреты атома на рисунке отражают наш нынешний уровень знаний о нем. Это и есть тот современный образ атома, который заменил собой модели Демокрита, Томсона и Бора. Конечно, и теперешние «портреты» не следует понимать слишком буквально: это отнюдь не «фотографии атомов», подобные фотографиям колеблющейся струны. Ни простыми, ни сложными приборами мы не можем прямо измерить распределение электронной плотности внутри атома, потому что это неизбежно разрушит его (даже арбуз, чтобы проверить его качества необходимо предварительно разрезать). И все же у нас есть много оснований верить найденной картине: с ее помощью мы можем последовательно объяснить все опыты которые привели нас к нынешнему образу атома.
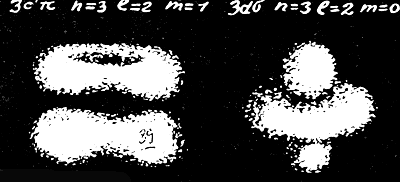
Форма электронного облака 2
Теперь нас не должно удивлять, что λ-частицы в опытах Резерфорда беспрепятственно пролетали сквозь миллиарды атомов, как через пустоту. Ведь, пронизывая кометные хвосты, Земля тоже никогда не отклоняется от своей орбиты. Понятен должен быть нам и механизм появления спектральных линий: просто атом скачком изменяет форму распределения электронного облака, излучая квант энергии. Мы должны теперь понять и расщепление частоты спектральных линий в электрическом поле (эффект Штарка) и в магнитном поле (эффект Зеемана): электронное облако заряжено, и его различные формы под воздействием полей немного изменяются, а вместе с ними изменяется и энергия кванта, которую необходимо затратить, чтобы перевести облако из одной формы в другую, и частота ν спектральной линии, которая этому кванту соответствует. Эти простые качественные рассуждения можно подтвердить строгими расчетами и доказать, что они совпадают с экспериментальными фактами.
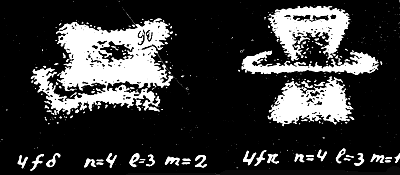
Форма электронного облака 3
Но сейчас нам важнее понять другое: а почему мы уверены, что созданный нами образ атома соответствует истине?
Форма электронного облака 4
КВАНТОВАЯ ИСТИНА
Прежде всего, о какой истине пойдет речь? И что понимают под истиной в квантовой механике? Если бы речь шла об арбузе, все было бы просто. Например, мы бы сразу сказали, что знания одного только распределения плотности нам недостаточно — это еще далеко не вся истина об арбузе. Лишь когда мы увидим, потрогаем, съедим его, наконец, мы сможем сказать, что он собой на самом деле представляет. Но даже такое, по мнению большинства людей, полное знание для ученых весьма предварительно. Они начнут рассматривать арбуз под микроскопом и скажут, что он состоит из клеток. Немного позже они заявят, что клетки построены из молекул, потом — что молекулы из атомов... Круг замкнулся. Чтобы узнать до конца арбуз, мы снова должны ответить на вопрос: «Что такое атом?»
В действительности, дело обстоит не так плохо: понятие «арбуз» сформировалось за много веков до появления всякой науки и не очень зависит от прошлых и будущих ее достижений, поскольку опирается только на наши ощущения. Это понятие может измениться лишь в том случае, если вдруг у всех людей одновременно появится еще одно — шестое чувство. Полагая это нереальным, мы с легким сердцем и говорим, что знаем об арбузе всю истину, если подвергли его испытанию своих пяти чувств. (Вспомните, как вы сами покупаете арбуз: сначала выбираете издали один из них, потом берете его в руки, иногда подносите к уху, чтобы услышать легкий треск и, наконец, надрезав его, пробуете на вкус.)
Можно ли с такой же меркой подходить к понятию «атом»? Ведь число опытов, на основе которых мы строим образ и понятие «атом», безгранично и в принципе каждый из них добавляет к нашим знаниям нечто новое. Мы не можем остановиться на этом пути и сказать: «Хватит с нас опытов, мы уже построили для себя образ атома, и дальнейшие опыты могут его только испортить». Наоборот, мы радуемся каждому новому опыту и особенно тем из них, которые не укладываются в рамки нами же придуманных образов. Именно такие опыты помогли нам отказаться от атомов — твердых шариков и построить нашу более совершенную модель. Почему же мы теперь уверены, что нынешний образ атома соответствует истине?
Надо признаться, что физики в этом вовсе не уверены. Зато они честно и спокойно могут сказать: «За последние сто лет не сделано ни одного опыта, который противоречил бы созданной нами картине. Поэтому лучше говорить не об ее истинности, а об ее плодотворности — о том, насколько она помогает нам объяснить и предсказывать особенности атомных явлений».
И здесь выясняется поразительная вещь: нам не так уж необходимо знать, «как выглядит атом на самом деле». Нам достаточно изучить уравнения квантовой механики и правила обращения с ними. После этого мы можем предсказать все: как изменится цвет тела при нагревании, какие спектральные линии оно при этом испустит и как изменится длина их волны, если поместить тело в электрическое или магнитное поле. Мы можем предсказать форму кристаллов, их теплоемкость и проводимость. Мы можем, наконец, построить атомную электростанцию и атомный ледокол, и они будут исправно работать. И все это без малейших ссылок на «истинную» форму атома.
На этом основании многие (с легкой руки Гейзенберга) предлагают обходиться в квантовой механике вообще без наглядных образов. Целесообразность такой крайности можно оспаривать, но отрицать ее возможность безоговорочно нельзя. На вопрос «Что такое атом?» сторонники крайних мер отвечают лаконично: «Атом есть система дифференциальных уравнений». К сожалению, в этой шутке много правды. По сравнению с целым арбузом «атом арбуза» очень беден свойствами. Однако свойства эти противоречивы, и слить их воедино без насилий над логикой и здравым смыслом можно пока только в уравнениях квантовой механики.
Квантовая механика — это математическая схема, которая позволяет вычислять физически измеримые характеристики атомных явлений: уровни энергии атомов, интенсивность и частоту спектральных линий, их расщепление в электрическом и магнитном полях и еще многое другое.
Если бы задача физики заключалась только в этом, то построение механики атома можно было бы считать законченным. Однако физика призвана дать нам нечто большее — рациональную картину мира. Выполнить столь обширную программу с одними формулами и числами нельзя — необходимо найти образы и сформулировать понятия, им соответствующие. Особенно интересно это для всех нефизиков, которые не знают и не понимают формул квантовой механики. Для них язык образов и понятий — единственный способ проникнуть в глубь атома. Со времен Демокрита мы продвинулись на этом пути довольно далеко и сейчас нарисовали для себя более или менее удовлетворительную картину атома. Однако до совершенства ей не хватает еще нескольких штрихов.
В самом деле, мы знаем теперь, что дуализм «волна — частица» — главное свойство всех атомных явлений. Но ведь сам по себе электрон все-таки частица? А мы сейчас ударились в другую крайность и утверждаем, что электрон в атоме — это некое заряженное облако. Для понимания большинства опытов такая картина удобна, однако с ее помощью нельзя понять, например, явление фотоэффекта. Действительно, никто никогда не видел, чтобы из атома вылетал кусок электронного облака — всегда вылетает единый и неделимый электрон. Как же происходит мгновенное собирание атомных облаков разной формы всегда в одну и ту же неделимую частицу?
Чтобы ответить на эти вопросы, нам придется ввести новое понятие — вероятность. Оно настолько фундаментально, что без него современной квантовой механики не существует вообще. Теперь мы им и займемся.
ВОКРУГ КВАНТА
ЖИЗНЬ...
Роджер Иозеф Боскович (1711—1787) сейчас известен только узкому кругу специалистов, но в начале прошлого века он был знаменит, а его теория атома оказала влияние даже на мировоззрение таких людей, как Фарадей и Максвелл.
Боскович родился и провел детские годы в Югославии, в Дубровнике (в то время — Рагуса). Он был восьмым ребенком из девяти и самым младшим из шести сыновей в семье крупных торговцев. То было время, когда любая деятельность людей получала смысл и признание лишь в том случае, если она была освящена церковью или связана с нею. Уже с 8 лет Боскович учился в местном иезуитском колледже, а в 14 лет отправился на родину матери, в Рим, и после двух лет искуса был принят в Collegium Romanum. Там он отличился в математике, физике и астрономии и в 1736 году опубликовал первую научную работу о солнечном экваторе и периоде вращения Солнца. В 29 лет он стал преподавателем, а в 33 года — священником и членом общества Иисуса. В продолжение 14 лет он преподает физику и математику, изучает аберрацию света и форму Земли, создает карту Ватикана.
Боскович был не только ученый, но и поэт. (В 1779 году он посвятил поэму Людовику XVI, в которой предсказывал ему царствование без солнечных затмений.) Яркие качества его богатой натуры в сочетании с блестящим интеллектом открыли ему доступ в высшие духовные, академические и дипломатические круги Европы.
В 1757 году он едет в Вену в составе посольства и там за одиннадцать месяцев пишет книгу «Теория натуральной философии», которую он обдумывал в течение двенадцати лет. После возвращения из Вены он отправился в четырехлетнее путешествие в Париж, Лондон, Константинополь, затем читал лекции, работал в обсерватории в Милане, снискал ненависть коллег независимостью взглядов и в 1772 году оказался в Венеции без средств к жизни. Друзья выхлопотали ему место в Париже, где он прожил десять лет и лишь в 1783 году возвратился в Италию издавать свои труды. В конце 1786 года он почувствовал признаки умственного расстройства, которое перешло в патологическую меланхолию. После попытки к самоубийству он сошел с ума и 13 февраля 1787 года избавился наконец от всех сложностей своей жизни.
...И АТОМ БОСКОВИЧА
Из тех немногих, кто в XVIII веке верил в атомы, Боскович — единственный, кто не верил в атомы — твердые шарики. Поэтому его воззрения ближе к нам, чем все атомные теории XIX века.
Свое недоверие к несжимаемым атомам-шарикам Боскович обосновывал тем, что с помощью таких атомов нельзя объяснить кристаллическую структуру тел и их упругость, плавление твердых веществ, испарение жидкостей, а тем более химические реакции между веществами, построенными из таких круглых, твердых и непроницаемых шаров.
Боскович представлял себе атом, как центр сил, которые меняются в зависимости от расстояния до этого центра. Близко к центру силы отталкивающие, что соответствует отталкиванию атомов при тесном сближении или при их столкновении. При удалении от центра отталкивающая сила сначала уменьшается, затем обращается в нуль и, наконец, становится притягивающей — как раз в этот момент, говорил Боскович, образуются все жидкие и твердые тела. Но если мы еще удалимся от центра сил, то силы вновь станут отталкивающими — в этот момент жидкие тела испаряются. И совсем далеко от атома силы всегда притягивающие, как того и требует закон всемирного тяготения Ньютона.
Таким образом, каждый атом Босковича «простирается вплоть до границ солнечной системы», а поскольку центры сил нельзя ни уничтожить, ни создать, то его атомы вечны, так же как и атомы Демокрита.
Атом Босковича
Атом Босковича значительно ближе к современному атому, чем атом Демокрита. Например, как и современный атом, он не имеет определенных геометрических размеров. Зато с его помощью можно понять разнообразие форм кристаллов и всевозможные химические превращения, в которых эти атомы участвуют.
Взгляните на рисунок, взятый из книги Босковича. Он изображает закон изменения сил, как его представлял себе он сам. Конечно, атом Босковича — это умозрительная схема, которая не опирается ни на опыт, пи на математику, а лишь на здравый смысл и внимательные наблюдения над природой. Сам Боскович писал: «Существуют, однако, определенные вещи, связанные с законом сил, относительно которых все мы невежды. Они касаются находящихся между ними дуг и других вещей того же рода. Все это, однако, далеко превосходит человеческое разумение, и только Он один, кто создал вселенную, имел перед своими глазами целое».
На рисунке рядом нарисован закон изменения сил, действующих между двумя атомами водорода. Можно только удивляться, насколько он похож на картинку Босковича. Но этот закон вычислен из уравнений квантовой механики без всякого произвола и ссылок на божественное провидение. С помощью этого закона сил мы можем предсказать спектр молекулы водорода, вычислить заранее энергию, которую необходимо затратить, чтобы оторвать один атом водорода от другого, мы можем предвидеть, что произойдет, если смешать водород, например, с хлором, и что изменится, если облучать эту смесь ультрафиолетовыми лучами.
Квантовая механика позволяет вычислить закон изменения сил между двумя произвольными атомами. В принципе она в состоянии рассчитать форму кристаллов. Она даже может предсказать цвет химических соединений. Конечно, все это доступно только тем, кто владеет довольно сложной математикой атомной физики. Однако понять многие особенности строения и свойства веществ может каждый, кто хоть немного знаком с ее образами.
|
ПОИСК:
|