
ГЛАВА 14. CTPOEHPIE МАТЕРИИ
РАДИОАКТИВНЫЙ РАСПАД
1. РАДИОАКТИВНЫЕ ПРЕВРАЩЕНИЯ
Эрнест Резерфорд родился в Новой Зеландии в английской семье. В Новой Зеландии он получил высшее образование, а затем в 1895 г. приехал в Кембридж и занялся научной работой в качестве ассистента Томсона. В 1898 г. Резерфорд был приглашен на кафедру физики Монреальского университета Мак-Гилла (Канада), где продолжал исследование радиоактивности, начатое еще в Кембридже.
В 1899 г. в Монреале коллега Резерфорда Оунз сообщил ему, что радиоактивность тория чувствительна к потокам воздуха. Это наблюдение показалось любопытным, Резерфорд заинтересовался и обнаружил, что радиоактивность соединений тория, если торий находится в закрытой ампуле, сохраняет постоянную интенсивность, если же опыт производится на открытом воздухе, то она быстро уменьшается, причем на результатах сказываются даже слабые потоки воздуха. Кроме того, тела, расположенные по соседству с соединениями тория, спустя некоторое время сами начинают испускать излучение, как если бы они тоже были радиоактивными. Это свойство Резерфорд назвал «возбужденной активностью».
Резерфорд довольно скоро понял, что все эти явления можно легко объяснить, если предположить, что соединения тория испускают, кроме α-частиц, еще другие частицы, которые в свою очередь радиоактивны. Вещество, состоящее из этих частиц, он назвал «эманацией» и считал его подобным радиоактивному газу, который, располагаясь тончайшим невидимым слоем на телах, находящихся рядом с выделяющим эту эманацию торием, сообщает этим телам кажущуюся радиоактивность. Руководствуясь этим предположением, Резерфорд сумел отделить этот радиоактивный газ с помощью простой вытяжки воздуха, имевшего соприкосновение с препаратом тория, а затем, введя его в ионизационную камеру, определил таким образом его активность и основные физические свойства. В частности, Резерфорд показал, что степень радиоактивности эманации (окрещенной позднее тороном, подобно тому как были названы радоном и актиноном радиоактивные газы, испускаемые радием и актинием) очень быстро уменьшается в геометрической прогрессии в зависимости от времени: каждую минуту активность уменьшается вдвое, через десять минут она уже становится совсем незаметной.

Эрнест Резерфорд
Тем временем супруги Кюри показали, что радий тоже обладает свойством возбуждать активность близлежащих тел. Для объяснения радиоактивности осадков радиоактивных растворов они приняли выдвинутую Беккерелем теорию и назвали это новое явление «индуцированной радиоактивностью». Супруги Кюри полагали, что индуцированная радиоактивность вызывается каким-то особым возбуждением тел лучами, испускаемыми радием: нечто похожее на фосфоресценцию, которой они прямо уподобляли это явление. Впрочем, Резерфорд, говоря о «возбужденной активности», первое время тоже, должно быть, имел в виду явление индукции, которое физика XIX века вполне готова была принять. Но Резерфорду уже было известно нечто большее, нежели супругам Кюри: он знал, что возбуждение, или индукция, было не прямым следствием воздействия тория, а результатом действия эманации. Тогда Кюри еще не открыли эманации радия, она была получена Латером и Дорном в 1900 г., после того как они повторили такие же исследования радия, какие Резерфорд провел ранее с торием.
Весной 1900г., опубликовав свое открытие, Резерфорд прервал исследования и вернулся в Новую Зеландию, где должна была состояться его свадьба. По возвращении в Монреаль в том же году он встретился с Фредериком Содди (1877-1956), окончившим химический факультет в Оксфорде в 1898 г. и также недавно приехавшим в Монреаль. Встреча этих двух молодых людей была счастливым событием для истории физики. Резерфорд рассказал Содди о своем открытии, о том, что ему удалось выделить торон, подчеркнул широкое поле исследований, которое здесь открывалось, и предложил ему объединиться для совместного химико-физического изучения соединения тория. Содди согласился.
Это исследование заняло у молодых ученых два года. Содди, в частности, изучил химическую природу эманации тория. В результате своих исследований он показал, что новый газ совершенно не вступает ни в какие известные химические реакции. Поэтому оставалось предположить, что он принадлежит к числу инертных газов, а именно (как Содди определенно показал в начале 1901 г.) новый газ по своим химическим свойствам подобен аргону (сейчас известно, что это один из его изотопов), который Рэлей и Рамсей обнаружили в воздухе в 1894 г.
Упорная работа двух молодых ученых увенчалась новым значительным открытием: вместе с торием в их препаратах был обнаружен другой элемент, отличавшийся по химическим свойствам от тория, а по активности превосходивший торий по крайней мере в несколько тысяч раз. Этот элемент был химически отделен от тория осаждением с помощью аммиака. По примеру Уильяма Крукса, который в 1900 г. назвал радиоактивный элемент, полученный им из урана, ураном X, молодые ученые назвали новый радиоактивный элемент торием X. Активность этого нового элемента в течение четырех дней уменьшается наполовину; этого времени было достаточно, чтобы обстоятельно изучить его. Исследования позволили сделать не подлежащий сомнению вывод: эманация тория получается вовсе не из тория, как это казалось, а из тория X. Если в некотором образце тория торий X отделялся от тория, то интенсивность радиации тория была сначала намного меньше, чем до разделения, но постепенно она увеличивалась со временем по экспоненциальному закону благодаря постоянному образованию нового радиоактивного вещества.
В первой работе 1902 г. ученые, объясняя все эти явления, пришли к выводу, что
«...радиоактивность - это атомное явление, сопровождающееся химическими изменениями, в котором порождаются новые виды вещества. Эти изменения д0лжны происходить внутри атома, а радиоактивные элементы являются, должно быть, спонтанными превращениями атомов... Поэтому радиоактивность нужно рассматривать как проявление внутриатомного химического процесса» (Philosophical Magazine, (6), 4, 395 (1902)).
А в следующем году они писали уже более определенно:
«Радиоактивные элементы обладают среди всех других элементов самым большим атомным весом. Это, собственно, и есть их единственное общее химическое свойство. В результате атомного распада и выбрасывания тяжелых заряженных частиц с массой того же порядка, что и масса атома водорода, остается новая система, более легкая, чем первоначальная, с физическими и химическими свойствами, совершенно отличными от свойств исходного элемента. Процесс распада, начавшись однажды, затем уже переходит с одной ступени на другую с определенными скоростями, вполне измеримыми. На каждой ступени испускается одна или несколько α-частиц, пока не достигаются последние ступени, когда α-частицы или электроны уже испущены. По-видимому, целесообразно было бы дать специальные названия этим новым осколкам атомов и новым атомам, которые получаются из первоначального атома после испускания частицы и существуют лишь ограниченный отрезок времени, постоянно подвергаясь дальнейшим изменениям. Их отличительным свойством является неустойчивость. Количества, в которых они могут скопляться, очень невелики, так что маловероятно, чтобы их можно было изучать обычными способами. Неустойчивость и связанное с ней испускание лучей и дают нам способ их изучения. Поэтому мы предлагаем называть эти осколки атомов "метаболонами"» (Philosophical Magazine, (6), 5, 536 (1903)).
Предложенный термин не удержался, потому что эта первая осторожная попытка сформулировать теорию была вскоре исправлена самими авторами и уточнена в ряде неясных пунктов, которые, наверно, отметил и сам читатель. В исправленном виде теория уже не нуждалась в новом термине и лет десять спустя одним из этих молодых ученых, ставшим к тому времени уже ученым с мировым имененем и лауреатом Нобелевской премии по физике, была выражена так:
«Атомы радиоактивного вещества подвержены спонтанным видоизменениям. В каждый момент небольшая часть общего числа атомов становится неустойчивой и взрывообразно распадается. В подавляющем большинстве случаев с огромной скоростью выбрасывается осколок атома - α-частица, в некоторых других случаях взрыв сопровождается выбрасыванием быстрого электрона и появлением рентгеновских лучей, обладающих большой проникающей способностью и известных под названием γ-излучения. Радиация сопровождает превращения атомов и служит мерой, определяющей степень их распада. Было обнаружено, что в результате атомного превращения образуется вещество совершенно нового вида, полностью отличное по своим физическим и химическим свойствам от первоначального вещества. Это новое вещество, однако, само тоже неустойчиво и испытывает превращение с испусканием характерного радиоактивного излучения...
Таким образом, точно установлено, что атомы некоторых элементов подвержены спонтанному распаду, сопровождающемуся излучением энергии в количествах, огромных по сравнению с энергией, освобождающейся при обычных молекулярных видоизменениях» (E. Rutherford, The structure of the atom, Scientia, 16, 339 (1914)).
В уже цитировавшейся статье 1903 г. Резерфорд и Содди составили таблицу «метаболонов», которые, согласно их теории, образуются в соответствии с их собственными опытами и опытами других ученых как продукты распада:
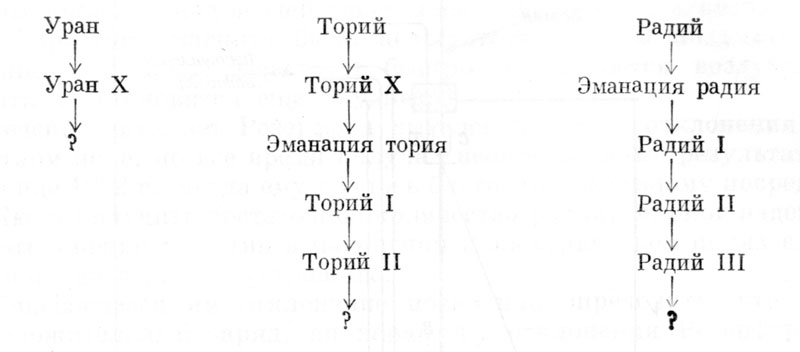
Таковы первые «генеалогические деревья» радиоактивных веществ. Постепенно другие вещества заняли свое место в этих семействах естественных радиоактивных элементов, и было установлено, что таких семейств всего три, из коих два имеют родоначальником уран, а третье - торий. Первое семейство насчитывает 14 «потомков», т. е. 14 элементов, получающихся один из другого в результате последовательного распада, второе - 10, третье - 11; в любом современном учебнике физики можно найти подробное описание этих «генеалогических деревьев».
Позволим себе одно замечание. Сейчас может казаться вполне естественным, более того, само собой разумеющимся тот вывод, к которому пришли в результате своих опытов Резерфорд и Содди. По сути дела, о чем шла речь? О том, что спустя некоторое время в первоначально чистом тории оказывалась примесь нового элемента, из которого в свою очередь образовывался газ, также обладающий радиоактивностью. Образование новых элементов можно видеть наглядно. Наглядно, но не очень. Нужно иметь в виду, что количества, в которых образовывались новые элементы, были очень далеки от тех минимальных доз, которые в то время были необходимы для самого точного химического анализа. Речь шла о едва заметных следах, которые можно обнаружить лишь радиоактивными методами, по фотографии и ионизации. Но все эти эффекты можно было объяснить и другим способом (индукцией, присутствием новых элементов в исходных препаратах с самого начала, как это было при открытии радия, и т. п.). То, что распад вовсе не был так уж очевиден, ясно хотя бы из того, что ни Крукс, ни Кюри не увидели ни малейшего намека на это, хотя и наблюдали аналогичные явления. Нельзя умолчать и о том, что нужно было большое мужество, чтобы в 1903 г., в самый разгар триумфа атомистики, говорить о превращениях элементов. Эта гипотеза отнюдь не была защищена от всевозможной критики и, быть может, не устояла бы, если бы Резерфорд и Содди с удивительным упорством не отстаивали ее в течение целых десятилетий, прибегая все к новым доказательствам, о которых мы еще будем говорить.
Нам кажется уместным прибавить здесь, что теория радиоактивной индукции также оказала большую услугу науке, предотвратив распыление сил в поисках новых радиоактивных элементов при каждом проявлении радиоактивности у нерадиоактивных элементов.
2. ПРИРОДА α-ЧАСТИЦ
Очень важным пунктом в теории радиоактивного распада, который мы до сих пор обходили, однако, молчанием в целях простоты изложения, является природа α-частиц, испускаемых радиоактивными веществами, ибо гипотеза, приписывающая им корпускулярные свойства, имеет определяющее значение для теории Резерфорда и Содди.
Сначала α-частицы - медленная, легко поглощаемая веществом компонента излучения - после их открытия Резерфордом не привлекали особого внимания физиков, интересовавшихся преимущественно быстрыми β-лучами, обладающими в сто раз большей проникающей способностью, нежели α-частицы.
Тот факт, что Резерфорд предугадал важность α-частиц для объяснения радиоактивных процессов и многие годы посвятил их изучению, является одним из самых ясных проявлений гениальности Резерфорда и одним из главных факторов, определивших успех его деятельности.
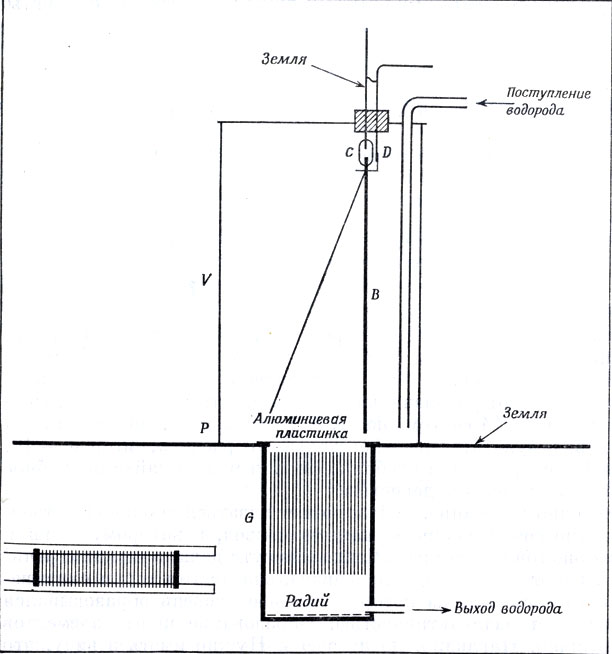
Первая установка Резерфорда для определения отклонения α-лучей в электрическом и магнитном полях. Лучи, испускаемые слоем радия, проходят через ряд узких щелей G, образованных вертикально помещенными металлическими полосками, и очень тонкую алюминиевую пластинку (толщиной 0,03-0,04 лип) в резервуар У, где они ионизуют содержащийся в нем водород. Ионизация измеряется по спаданию пластины из фольги в электроскопе Б, заряженном снаружи через провод D. Если создается горизонтальное магнитное поле, перпендикулярное плоскости рисунка, то α-лучи отклоняются на металлические пластинки и поглощаются ими; поэтому в резервуар V попадает меньшее число частиц и фольга электроскопа опускается медленнее. Поток сухого водорода попадает в резервуар V, проникает через алюминиевую пластинку и через щели G и выходит внизу, что препятствует проникновению в ионизационную камеру эманации радия, которая искажала бы результат. Этот же прибор служит для наблюдения отклонения лучей в электрическим поле; для этого соединяют каждую вертикальную пластинку с полюсом электрической батареи так, чтобы между всеми пластинками создавались электрические поля одинакового направления
В 1900 г. Роберт Рэлей (Роберт Стретт, сын Джона Уильяма Рэлея) и независимо от него Крукс выдвинули гипотезу, не подтвержденную никаким опытным доказательством, согласно которой α-частицы несут положительный заряд. Сегодня очень хорошо можно понять те трудности, которые стояли на пути экспериментального исследования α-частиц. Этих трудностей две: во-первых, α-частицы намного тяжелее β-частиц, поэтому они незначительно отклоняются под воздействием электрических и магнитных полей, и, конечно, простого магнита было недостаточно, чтобы получить заметное отклонение; во-вторых, α-частицы быстро поглощаются воздухом, отчего наблюдать их становится еще труднее.
В течение двух лет Резерфорд пытался добиться отклонения α-частиц в магнитном поле, но все время получал неопределенные результаты. Наконец, в конце 1902 г., когда ему удалось благодаря любезному посредничеству Пьера Кюри получить достаточное количество радия, он смог надежно установить отклонение α-частиц в магнитном и электрическом полях с помощью показанного на стр. 364 устройства.
Наблюдавшееся им отклонение позволило определить, что α-частица несет положительный заряд; по характеру отклонения Резерфорд определил также, что скорость α-частицы приблизительно равна половине скорости света (позднейшие уточнения уменьшили скорость примерно до одной десятой скорости света); отношение e/m получилось равным приблизительно 6000 электромагнитных единиц. Из этого следовало, что если α-частица несет элементарный заряд, то ее масса должна быть вдвое больше массы атома водорода. Резерфорд отдавал себе отчет в том, что все эти данные в высшей степени приближенны, но один качественный вывод они все же позволяли сделать: α-частицы обладают массой того же порядка, что и атомные массы, и поэтому подобны каналовым лучам, которые наблюдал Гольдштейн, но обладают значительно большей скоростью. Полученные результаты, говорит Резерфорд, «проливают свет на радиоактивные процессы», и отражение этого света мы уже видели в цитировавшихся отрывках из статей Резерфорда и Содди.
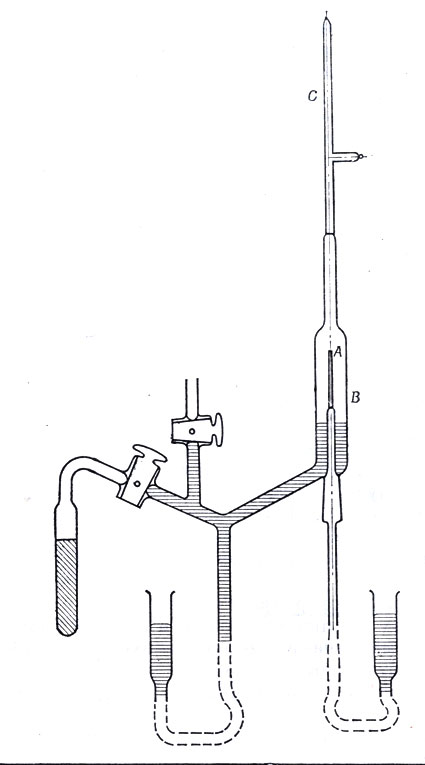
Аппарат Резерфорда и Ройдса для доказательства образования гелия при распаде радона. Толщина стенок стеклянной трубки А, сделанной опытным стеклодувом, равна 5-8 мк. Трубка наполнена газом радоном. Испускаемые им α-частицы проходят через стенки трубки А в объем Б. Спустя некоторое время столбик ртути в трубке В подымается, сжимая содержащийся в трубке газ в отростке С. При спектроскопическом исследовании этого газа получается спектр гелия. Если трубку А наполнить гелием, то в объеме Б не обнаруживается следов гелия. Таким образом, через стенки трубки А проникают только α-частицы, а не атомы гелия, которые почему-либо могли бы там оказаться
В 1903 г. Мария Кюри подтвердила открытие Резерфорда с помощью описываемой теперь во всех учебниках физики установки, в которой благодаря сцинтилляции, вызываемой всеми лучами, которые испускает радий, можно было одновременно наблюдать противоположные отклонения α-частиц и β-лучей и невосприимчивость γ-излучения к электрическому и магнитному полям.
Теория радиоактивного распада навела Резерфорда и Содди на мысль, что все устойчивые вещества, получающиеся при радиоактивных превращениях элементов, должны присутствовать в радиоактивных рудах, в которых эти превращения происходят уже в течение многих тысяч лет. Не следует ли тогда считать гелий, найденный Рамсеем и Траверсом в урановых рудах, продуктом радиоактивного распада?
С начала 1903 г. изучение радиоактивности получило неожиданно новый толчок благодаря тому, что Гизель (фирма «Хининфабрик», Брауншвейг) выпустил в продажу по сравнительно умеренным ценам такие чистые соединения радия, как гидрат бромистого радия, содержащий 50% чистого элемента. До этого приходилось работать с соединениями, содержавшими самое большее 0,1% чистого элемента!
К тому времени Содди вернулся в Лондон, чтобы продолжать там изучение свойств эманации в химической лаборатории Рамсея - единственной тогда в мире лаборатории, где можно было проводить исследования такого рода. Он купил 30 мг поступившего в продажу препарата, и этого количества оказалось ему достаточно, чтобы вместе с Рамсеем в том же 1903 г. доказать, что гелий присутствует в радии, имеющем возраст несколько месяцев, и что при распаде эманации образуется гелий.
Но какое место занимал гелий в таблице радиоактивных превращений? Был ли он конечным продуктом превращений радия или же продуктом какой-то из стадий его эволюции? Резерфорд очень скоро догадался, что гелий образуемся α-частицами, испускаемыми радием, что каждая α-частица является атомом гелия с двумя положительными зарядами. Но чтобы доказать это, понадобились годы работы. Доказательство было получено лишь тогда, когда Резерфорд и Гейгер изобрели счетчик α-частиц, о котором мы говорили в гл. 13. Измерение заряда отдельной α-частицы и определение отношения e/m сразу же дало для ее массы m значение, равное массе атома гелия.
И все же все эти исследования и подсчеты еще не доказывали решительно, что α-частицы тождественны с ионами гелия. В самом деле, если бы, скажем, одновременно с выбрасыванием α-частицы освобождался атом гелия, то все опыты и расчеты оставались бы в силе, но α-частица могла бы быть и атомом водорода или какого-нибудь другого неизвестного вещества. Резерфорд хорошо понимал возможность такой критики и, чтобы отклонить ее, в 1908 г. вместе с Ройдсом дал решительное доказательство своей гипотезы с помощью установки, схематически изображенной на приведенном рисунке: α-частицы, испускаемые радоном, собираются и накапливаются в трубке для спектроскопического анализа; при этом наблюдается характерный спектр гелия.
Таким образом, начиная с 1908 г. уже не было никаких сомнений в том, что α-частицы являются ионами гелия и что гелий представляет собой составную часть естественных радиоактивных веществ.
Прежде чем перейти к другому вопросу, добавим еще, что через несколько лет после обнаружения гелия в урановых рудах американский химик Болтвуд, исследуя руды, содержащие уран и торий, пришел к выводу, что последним нерадиоактивным продуктом последовательного ряда превращений урана является свинец и что, кроме того, радий и актиний - сами продукты распада урана. Таблица «метаболонов» Резерфорда и Содди должна была, таким образом, претерпеть существенное изменение.
Теория атомного распада приводила к еще одному новому интересному следствию. Поскольку радиоактивные превращения происходят с неизменной скоростью, которую не мог изменить никакой физический фактор, известный в то время (1930 г.), то по соотношению количеств урана, свинца и гелияг присутствующих в урановой руде, можно определить возраст самой руды, т. е. возраст Земли. Первый подсчет дал цифру в один миллиард восемьсот миллионов лет, но Джон Джоли (1857-1933) и Роберт Рэлей (1875-1947), проведшие важные исследования в этой области, считали эту оценку весьма неточной. Сейчас возраст урановых руд считают примерно равным полутора миллиардам лет, что не очень отличается от первоначальной оценки.
3. ОСНОВНОЙ ЗАКОН РАДИОАКТИВНОСТИ
Мы уже говорили, что Резерфорд установил на опыте экспоненциальный закон убывания активности эманации тория со временем: активность уменьшается вдвое примерно за одну минуту. Все радиоактивные вещества, исследованные Резерфордом и другими, подчинялись качественно такому же закону, но каждому из них соответствовал свой период полураспада. Этот экспериментальный факт выражается простой формулой (Эта формула имеет вид
N=N0e-λi
где λ постоянная полураспада, а обратная ей величина есть среднее время жизни элемента. Время, необходимое для того, чтобы число атомов уменьшилось вдвое, называется периодом, или временем, полураспада. Как мы уже сказали, А, сильно изменяется от элемента к элементу и, следовательно, меняются и все другие зависящие от нее величины. Например, среднее время жизни урана I равно 6 миллиардам 600 миллионам лет, а актиния А - трем тысячным долям секунды), устанавливающей соотношение между числом N0 радиоактивных атомов в начальный момент и числом еще не распавшихся атомов в момент t. Этот закон можно выразить иначе: доля атомов, распадающихся за определенный промежуток времени, является постоянной, характеризующей элемент, и называется постоянной радиоактивного распада, а величина, обратная ей, называется средним временем жизни.
До 1930 г. не было известно какого-либо фактора, который влиял бы хоть в малейшей степени на естественную скорость этого явления. Начиная с 1902 г., Резерфорд и Содди, а затем и многие другие физики помещали радиоактивные тела в самые различные физические условия, но ни разу не получили ни малейшего изменения постоянной радиоактивного распада.
«Радиоактивность, - писали Резерфорд и Содди, - согласно нашим сегодняшним знаниям о ней, следует рассматривать как результат процесса, остающегося совершенно вне сферы действия известных нам и контролируемых сил; она не может быть ни создана, ни изменена, ни остановлена» (Philosophical Magazine, (6), 5, 582 (1903). ).
Среднее время жизни элемента - это точно определенная константа,, неизменная для каждого элемента, однако индивидуальное время жизни отдельного атома данного элемента совершенно неопределенно. Среднее время жизни не уменьшается со временем: оно одно и то же как для группы только что образовавшихся атомов, так и для группы атомов, образовавшихся в ранние геологические эпохи. Короче говоря, прибегая к антропоморфному сравнению, можно сказать, что атомы радиоактивных элементов умирают, но не стареют. В общем с самого начала основной закон радиоактивности показался совершенно непостижимым, каким остается и до наших дней.
Из всего сказанного ясно, и это было понятно сразу же, что закон радиоактивности - закон вероятностный. Он утверждает, что возможность распада атома в данный момент одинакова для всех имеющихся радиоактивных атомов. Речь идет, таким образом, о статистическом законе, который тем яснее выявляется, чем больше число рассматриваемых атомов. Если бы на явление радиоактивности влияли внешние причины, то объяснение этого закона было бы довольно простым: в таком случае атомами, распадающимися в данный момент, были бы как раз те атомы, которые находятся по отношению к воздействующей внешней причине в особенно благоприятных услов-виях. Эти особые условия, приводящие к распаду атома, можно было бы, например, объяснить тепловым возбуждением атомов. Иными словами, статистический закон радиоактивности имел бы тогда такой же смысл, как и статистические законы классической физики, рассматриваемые как синтез частных динамических законов, которые из-за большого их числа просто удобно рассматривать статистически.
Но данные опыта не давали абсолютно никакой возможности свести этот статистический закон к сумме частных законов, определяемых внешними причинами. Исключив внешние причины, стали искать причины превращения атома в самом атоме.
«Так как, - писала Мария Кюри, - в совокупности большого числа атомов некоторые из них немедленно разрушаются, в то время как другие продолжают существовать в течение очень долгого времени, то нельзя уже рассматривать все атомы одного и того же простого вещества как совершенно одинаковые, а следует признать, что различие в их судьбе определяется индивидуальными различиями. Но тогда возникает новая трудность. Различия, которые мы хотим учитывать, должны быть такого рода, что они не должны определять, так сказать, «старения» вещества. Они должны быть такими, чтобы вероятность того, что атом проживет еще некоторое данное время, не зависела от того времени, в течение которого он уже существует. Любая теория строения атомов должна удовлетворять этому требованию, если она основана на высказанных выше соображениях» (Rapports et discussions du Conseil Solvay tenu a Bruxelles du 27 au 30 avril 1913, Paris, 1921, p. 68-69).
Точку зрения Марии Кюри разделял и ее ученик Дебьерн, который выдвинул предположение, что каждый радиоактивный атом непрерывно быстро проходит через многочисленные различные состояния, сохраняя неизменным и независимым от внешних условий некое среднее состояние. Отсюда следует, что в среднем все атомы одного и того же вида обладают одинаковыми свойствами и одинаковой вероятностью распада, обусловливаемого неустойчивым состоянием, через которое атом время от времени проходит. Но наличие постоянной вероятности распада атома предполагает чрезвычайную его сложность, поскольку он должен состоять из большого числа элементов, подверженных беспорядочным движениям. Это внутриатомное возбуждение, ограниченное центральной частью атома, может привести к необходимости введения внутренней температуры атома, которая значительно выше внешней.
Эти соображения Марии Кюри и Дебьерна, не подтвержденные, однако, никакими опытными данными и не приведшие ни к каким реальным следствиям, не нашли отклика среди физиков. Мы вспомнили их потому, что оказавшаяся безрезультатной попытка классического истолкования закона радиоактивного распада была первым, или по крайней мере наиболее убедительным, примером статистического закона, который нельзя получить из законов индивидуального поведения отдельных объектов. Возникает новая концепция статистического закона, данного непосредственно, безотносительно к поведению индивидуальных объектов, составляющих совокупность. Такая концепция станет ясной лишь спустя десять лет после безуспешных усилий Кюри и Дебьерна.
4. РАДИОАКТИВНЫЕ ИЗОТОПЫ
В первой половине прошлого века некоторые химики, в частности Жан Батист Дюма (1800-1884), В заметили определенную связь между атомным весом элементов и их химическими и физическими свойствами. Эти наблюдения были завершены Дмитрием Ивановичем Менделеевым (1834-1907), который в 1868 г. опубликовал свою гениальную теорию периодической системы элементов, одно из самых глубоких обобщений в химии. Менделеев расположил известные в то время элементы в порядке возрастания атомного веса. Вот первые из них, с указанием их атомного веса по данным того времени:
7Li; 9,4Ве; 11В; 12С; 14N; 160; 19F;
23Na; 24Mg; 27,3Al; 28Si; 31P; 32S; 35,50Сl.
Менделеев заметил, что химические и физические свойства элементов являются периодическими функциями от атомного веса. Например, в первом ряду выписанных элементов плотность регулярно возрастает с увеличением атомного веса, достигает максимума в середине ряда, а затем уменьшается; такую же периодичность, хотя и не столь четкую, можно видеть и в отношении других химических и физических свойств (точка плавления, коэффициент расширения, проводимость, окисляемость и т. п.) для элементов как первого, так и второго ряда. Эти изменения происходят по одинаковому закону в обоих рядах, так что элементы, которые находятся в одной и той же колонке (Li и Na, Be и Mg и т. д.), обладают аналогичными химическими свойствами. Эти два ряда называются периодами. Таким образом, все элементы можно распределить по периодам в соответствии с их свойствами. Из этого и следует закон Менделеева: свойства элементов находятся в периодической зависимости от их атомных весов.

Д. И. Менделеев
Здесь не место рассказывать об оживленной дискуссии, которую вызвала периодическая классификация, и о ее постепенном утверждении благодаря бесценным услугам, которые она оказала развитию науки. Достаточно лишь указать, что к концу прошлого столетия она была принята почти всеми химиками, которые принимали ее как опытный факт, убедившись в тщетности всех попыток теоретически ее интерпретировать.
В самом начале XX века при обработке драгоценных камней на Цейлоне был открыт новый минерал, торианит, который, как известно сейчас, представляет собой ториево-урановый минерал. Некоторое количество торианита было послано в Англию для анализа. Однако при первом анализе из-за ошибки, которую Содди приписывает известной немецкой работе по аналитической химии, был спутан торий с цирконием, из-за чего исследуемое вещество, считавшееся урановой рудой, было подвергнуто обработке по методу Кюри для отделения радия от урановой руды. В 1905 г., применив указанный способ, Вильгельм Рамсей и Отто Хан (последний обессмертил свое имя тридцать лет спустя, открыв реакцию деления урана) получили вещество, которое химический анализ определял как торий, но которое отличалось от него гораздо более интенсивной радиоактивностью. Как и в случае тория, в результате его распада образовались торий X; торон и другие радиоактивные элементы. Интенсивная радиоактивность свидетельствовала о наличии в полученном веществе нового радиоактивного элемента, химически еще не определенного. Его назвали радиоторием. Вскоре выяснилось, что он представляет собой элемент из ряда распада тория, что он ускользнул от предшествовавшего анализа Резерфорда и Содди и должен быть вставлен между торием и торием X. Среднее время жизни радиотория оказалось равным примерно двум годам. Это достаточно долгий срок, чтобы радиоторий мог заменить в лабораториях дорогостоящий радий. Помимо чисто научного интереса, эта экономическая причина побудила многих химиков попытаться выделить его, но все попытки оказались безрезультатными. Никаким химическим процессом отделить его от тория не удавалось, более того, в 1907 г. проблема, казалось, еще более усложнилась, потому что Хан открыл мезоторий - элемент, порождающий радиоторий, который тоже оказался неотделимым от тория. Американские химики Мак-Кой и Росс, потерпев неудачу, имели смелость объяснять ее и неудачи других экспериментаторов принципиальной невозможностью отделения, но их современникам такое объяснение показалось лишь удобной отговоркой. Между тем в период 1907-1910 гг. были отмечены другие случаи, когда одни радиоактивные элементы не удавалось отделить от других. Наиболее типичными примерами были торий и ионий, мезоторий I и радий, радий D и свинец.
Некоторые химики уподобляли неотделимость новых радиоэлементов случаю с редкоземельными элементами, с которым химия столкнулась в XIX веке. Первое время сходные химические свойства редких земель заставили считать свойства этих элементов одинаковыми, и лишь позднее по мере совершенствования химических методов постепенно удалось отделить их. Однако Содди считал, что эта аналогия надуманная: в случае с редкими землями трудность состояла не в том, чтобы разделить элементыг а в том, чтобы установить факт их разделения. Напротив, в случае радиоактивных элементов с самого начала ясно различие двух элементов, а вот отделить их не удается.
В 1911 г. Содди провел систематическое исследование коммерческого препарата мезотория, содержащего также радий, и обнаружил, что относительное содержание одного из этих двух элементов увеличить невозможно, даже прибегая к многократной фракционной кристаллизации. Содди пришел к выводу, что два элемента могут обладать различными радиоактивными свойствами и тем не менее иметь настолько сходные другие химические и физические свойства, что они оказываются неразделимыми с помощью обычных химических процессов. Если два таких элемента обладают одинаковыми химическими свойствами, их следует помещать на одно и то же место в периодической таблице элементов; поэтому он назвал их изотопами.
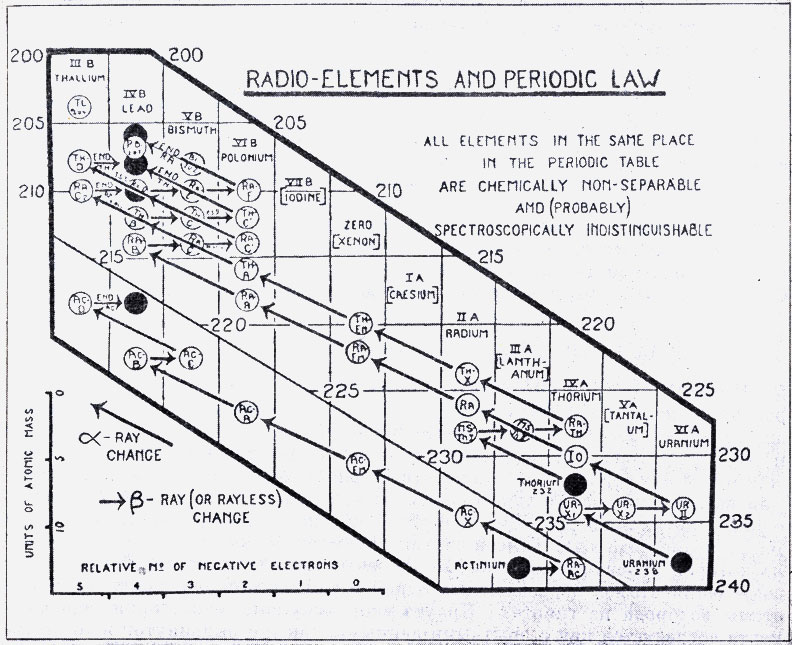
Диаграмма Содди, составленная им в 1913 г. для иллюстрации правила смещения при радиоактивных превращениях. (F. Sоddу, The origins of the conceptions of isotopes, Les Prix Nobel en 1921-1922.) По оси ординат отложены массы атомов, по оси абсцисс - порядковый номер элемента в периодической системе (атомный номер)
Исходя из этой основной идеи, Содди попытался дать теоретическое объяснение, сформулировав «правило смещения при радиоактивных превращениях»: испускание одной α-частицы приводит к смещению элемента на два места влево в периодической системе. Но превращенный элемент может впоследствии вернуться в ту же клетку периодической системы при последующем испускании двух β-частиц, в результате чего два элемента будут обладать одинаковыми химическими свойствами, несмотря на различные атомные веса. В 1911 г. химические свойства радиоактивных элементов, испускающих β-лучи и обладающих, как правило, очень малой продолжительностью жизни, были еще мало известны, поэтому, прежде чем принять такое объяснение, нужно было лучше узнать свойства элементов, испускающих β-лучи. Содди поручил эту работу своему ассистенту Флекку. Работа потребовала много времени, и в ней приняли участие оба ассистента Резерфорда - Рессел и Хевеши; позднее этим занялся также Фаянс.
Весной 1913 г. работа была завершена и правило Содди было подтверждено без всяких исключений. Его можно было сформулировать очень просто: испускание α-частицы уменьшает атомный вес данного элемента на 4 единицы и смещает элемент на два места влево в периодической системе; испускание же β-частицы не меняет существенно атомного веса элемента, но смещает его на одно место вправо в периодической системе. Поэтому если за превращением, вызванным испусканием α-частицы, следует два превращения с испусканием β-частиц, то после трех превращений элемент возвращается на первоначальное место в таблице и приобретает те же химические свойства, что и исходный элемент, обладая, однако, атомным весом, меньшим на 4 единицы. Из этого ясно следует также, что изотопы двух различных элементов могут иметь одинаковый атомный вес, но различные химические свойства. Стьюарт назвал их изобарами. На стр. 371 воспроизведена схема, иллюстрирующая правило смещения при радиоактивных превращениях в форме, данной Содди в 1913 г. Сейчас мы знаем, конечно, значительно больше радиоактивных изотопов, чем знал Содди в 1913 г. Но нам не стоит, пожалуй, прослеживать все эти последующие технические завоевания. Важнее лишний раз подчеркнуть главное: α-частицы несут два положительных заряда, а β-частицы - один отрицательный заряд; испускание любой из этих частиц изменяет химические свойства элемента. Глубокий смысл правила Содди состоит, таким образом, в том, что химические свойства элементов, или по крайней мере радиоактивных элементов, пока это правило не распространено дальше, связаны не с атомным весом, как это утверждала классическая химия, а с внутриатомным электрическим зарядом.
|
ПОИСК:
|