
Критическая температура
Как превратить газ в жидкость? График кипения отвечает на этот вопрос. Превратить газ в жидкость можно, либо уменьшая температуру, либо увеличивая давление.
В XIX веке повышение давления представлялось задачей более легкой, чем понижение температуры. В начале этого столетия великому английскому физику Михаилу Фараде удалось сжать газы до значений упругости паров и таким способом превратить в жидкость много газов (хлор, углекислый газ и др.).
Однако некоторые газы - водород, азот, кислород - никак не поддавались сжижению. Сколько ни увеличивали давление, они не превращались в жидкость. Можно было подумать, что кислород и другие газы не могут быть жидкими. Их причислили к истинным, или постоянным, газам.
На самом же деле неудачи были вызваны непониманием одного важного обстоятельства.
Рассмотрим жидкость и пар, находящиеся в равновесии, и подумаем, что происходит с ними при возрастании температуры кипения и, разумеется, соответствующем возрастании давления. Иначе говоря, представим себе, что точка на графике кипения движется вдоль кривой вверх. Ясно, что жидкость при повышении температуры расширяется и плотность ее падает. Что же касается пара, то увеличение температуры кипения? разумеется, способствует его расширению, но, как мы уже говорили, давление насыщенного пара растет значительно быстрее, чем температура кипения. Поэтому плотность пара не падает, а, наоборот, быстро растет с увеличением температуры кипения.
Поскольку плотность жидкости падает, а плотность пара растет, то, двигаясь "вверх" по кривой кипения, мы неминуемо доберемся до такой точки, в которой плотности жидкости и пара сравняются (рис. 4.3).
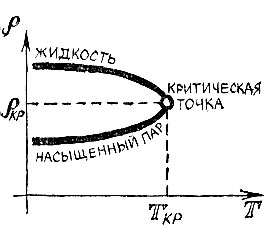
Рис. 4.3
В этой замечательной точке,- которая называется критической, кривая кипения обрывается. Так как все различия между газом и жидкостью связаны с разницей в плотности, то в критической точке свойства жидкости и газа становятся одинаковыми. Для каждого вещества существует своя критическая температура и свое критическое давление. Так, для воды критическая точка соответствует температуре 374°С и давлению 218,5 атм.
Если сжимать газ, температура которого ниже критической, то процесс его сжатия изобразится стрелкой, пересекающей кривую кипения (рис. 4.4). Это значит, что в момент достижения давления, равного упругости пара (точка пересечения стрелки с кривой кипения), газ начнет конденсироваться в жидкость. Если бы наш сосуд был прозрачным, то в этот момент мы увидели бы начало образования слоя жидкости на дне сосуда. При неизменном давлении слой жидкости будет расти, пока, наконец, весь газ не превратится в жидкость. Дальнейшее сжатие потребует уже увеличения давления.
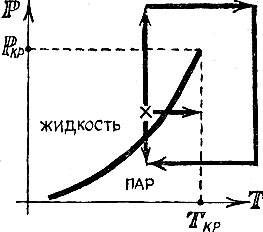
Рис. 4.4
Совершенно иначе обстоит дело при сжатии газа, температура которого выше критической. Процесс сжатия опять-таки можно изобразить в виде стрелки, идущей снизу вверх. Но теперь эта стрелка не пересекает кривую кипения. Значит, при сжатии пар не будет конденсироваться, а будет лишь непрерывно уплотняться.
При температуре выше критической невозможно существование жидкости и газа, поделенных границей раздела: При сжатии до любых плотностей под поршнем будет находиться однородное вещество, и трудно сказать, когда его можно назвать газом, а когда - жидкостью.
Наличие критической точки показывает, что между жидким и газообразным состоянием нет принципиального различия. На первый взгляд могло бы показаться, что такого принципиального различия нет только в том случае, когда речь идет о температурах выше критической. Это, однако, не так. Существование- критической точки указывает на возможность превращения жидкости - самой настоящей жидкости, которую можно налить в стакан - в газообразное состояние без всякого подобия кипения.
Такой путь превращения показан на рис. 4.4. Крестиком отмечена заведомая жидкость. Если немного понизить давление (стрелка вниз), она закипит, закипит она и в том случае, если немного повысить температуру (стрелка вправо). Но мы поступим совсем иначе, Сожмем жидкость весьма сильно, до давления выше критического. Точка, изображающая состояние жидкости, пойдет вертикально вверх. Затем подогреем жидкость - этот процесс изобразится горизонтальной линией. Теперь, после того как мы очутились правее Критической температуры, понизим давление до исходного. Если теперь уменьшить температуру, то можно получить самый настоящий пар, который мог быть получен из этой жидкости более простым и коротким путем.
Таким образом, всегда возможно, изменяя давление и температуру в обход критической точки, получить пар путем непрерывного перехода его из жидкости или жидкость из пара. Такой непрерывный переход не требует кипения или конденсации.
Ранние попытки сжижения таких газов, как кислород, азот, водород, потому и были неудачны, что не было известно о существовании критической температуры. У этих газов критические температуры очень низкие: у азота -147°С, у кислорода -119°С, у водорода -240°С, или 33 К. Рекордсменом является гелий, его критическая температура равна 4,3 К. Превратить эти газы в жидкость можно лишь одним' способом - надо снизить их температуру ниже указанной"
|
ПОИСК:
|