
Глава I. В недра вещества
§ 1. Как устроен атом
Вопрос о том, из чего состоят предметы, заполняющие мир, не нов. Он занимал ученых еще в глубокой древности. Более 2000 лет назад великий греческий философ-материалист Демокрит впервые высказал мысль о существовании мельчайших неделимых частиц вещества. Если начать делить на все более мелкие части кусок твердого вещества,- рассуждал он,- то настанет момент, когда дальнейшее деление станет невозможным. Так мы дойдем до последних неразделимых частиц материи - атомов ("атомос" по-гречески - неделимый). Атомы - твердые, вечные и неразрушимые. Из атомов и пространства между ними состоит мир. "Как трагедия, так и комедия могут быть написаны одними и теми же буквами, так же все разнообразие случающегося в мире осуществляется одинаковыми атомами, поскольку они имеют различные положения и выполняют различные движения". Однако большинство философов древности не разделяло взгляды Демокрита и его последователей. Вслед за Аристотелем, авторитет которого был очень велик, они отрицали возможность существования атомов. Лишь в эпоху Возрождения, более чем через семнадцать веков, когда усиленно начало развиваться естествознание, ученые вспомнили Демокрита и его рассуждения об атомарном строении материи. В отличие от греков, для которых атом был отвлеченным понятием, ученые XVII в.- Гассенди, Бойль, Ньютон - пытаются объяснить посредством атомной теории конкретные физические и химические свойства тел.
Дальнейшее развитие естествознания, связанное с именами Ломоносова, Лавуазье, Дальтона и других ученых, подтвердило гениальную догадку древних философов. Оказалось, что в природе действительно существуют атомы сравнительно небольшого количества простых веществ - элементов (к настоящему времени открыто 102 элемента). Именно атомы определяют химические свойства элементов, т. е. их способность вступать в соединения с другими элементами. Великому русскому химику Д. И. Менделееву в 1869 г. удалось открыть закон, объясняющий, почему тот или иной элемент обладает определенными химическими и физическими свойствами. Он показал, что основной характеристикой элемента является его атомный вес, т. е. отношение массы атома к массе атома водорода или, точнее, к Vie массы атома кислорода. Расположив все известные в то время элементы в порядке возрастания атомных весов, Менделеев обнаружил, что в свойствах элементов существует явная периодичность. В каждом столбце построенной таким образом системы оказались элементы с близкими химическими свойствами. Периодический закон Менделеева послужил основой для дальнейшего развития атомной физики. Позже была обнаружена глубокая связь открытого закона со строением атомов.
Соединение отдельных атомов образует молекулу сложного вещества. Количество разнообразных молекул в природе огромно. К настоящему времени их насчитываются сотни тысяч. Такие физические свойства вещества как вкус, цвет, запах, температура кипения определяются составом молекул и расположением атомов в них.
Хотя реальность существования атомов в конце XIX в. была твердо установлена, сказать об их устройстве можно было немногим больше, чем во времена Демокрита. "Атом считался неделимым. Он считался той последней границей, за пределы которой сама природа вещей не позволяет нам перейти. На атом смотрели как на нечто неделимое, непроницаемое, вечное, недоступное влиянию ни теплоты, ни электричества... Внутренность атома была объявлена той территорией, в которую физику никогда не удастся проникнуть..." - писал английский физик Дж. Дж. Томсон.
Первый серьезный удар по этим представлениям нанесло открытие электрона. Еще исследованные Фарадеем явления электролиза указывали на вероятное существование "атомов электричества" и связь их с атомами химических элементов. Однако открыты свободные "атомы электричества" - электроны -были значительно позднее, при изучении прохождения электрического тока через газы. Опыты показали, что электроны обладают отрицательным электрическим зарядом. Была найдена и масса электрона, оказавшаяся в 1836 раз меньше массы атома водорода. Как же связаны электроны с атомами вещества? Предполагалось, что электроны каким-то образом входят в состав атомов. В то же время было хорошо известно, что в целом атом, в его обычном состоянии, ведет себя как нейтральное, электрически незаряженное тело. Отсюда следовало, что в атоме существует и положительный заряд, который, по-видимому, компенсирует действие отрицательного заряда. Но как распределены положительные и отрицательные заряды в атоме, каково его строение - оставалось неясным.
Более того, в то время - в самом конце XIX в. - казалось, что опыт бессилен дать ответ на эти вопросы. Размеры атомов уже были известны - они равны стомиллионным долям сантиметра (10-8см). Это значит, что по длине на странице книжки уместится в ряд около двадцати миллиардов атомов. Такие предметы нельзя рассмотреть ни в какой микроскоп, так как микроскоп позволяет различить лишь те предметы, размеры которых больше длины волны применяемого для рассмотрения света. Длина волны видимого света (λ) составляет от 4*10-5 до 7*10-5см, т. е. гораздо больше размеров атомов. Не дает возможность "разглядеть" структуру атома и сравнительно недавно сконструированный электронный микроскоп (λ ≅ 10-8см), хотя он с успехом применяется для изучения строения молекул.
Не имея экспериментальных данных относительно строения атома, ученые пользовались представлением об устройстве атома, предложенным Дж. Дж. Томсоном. Согласно этой модели положительный заряд распределен более или менее равномерно по объему атома, а отрицательные заряды - электроны - вкраплены в положительный заряд в отдельных точках.
Прошло, однако, немногим более десяти лет, как выяснилось, что несмотря на ничтожно малые размеры атомов можно экспериментально изучить их строение. Когда эти опыты были проведены, стало ясным, что атом устроен совсем не так, как это представлялось физикам.
Незадолго до этого, в 1895 г., немецкий физик Рентген открыл лучи, обладавшие невиданной до этого времени способностью легко проникать сквозь сравнительно толстые слои вещества. Фотографические пластинки, тщательно завернутые в несколько слоев черной бумаги, после помещения в пучок этих лучей, названных рентгеновскими, чернели. Рентгеновские лучи возникали при падении быстрых электронов на различные вещества. Ни электрическое, ни магнитное поле не влияли на направление потока этих лучей. Такое поведение их позволило физикам определить природу рентгеновских лучей; они, подобно свету,- электромагнитные волны, но имеют в тысячи раз меньшую длину волны. Соответственно, энергия рентгеновских лучей гораздо больше световой, чем и объясняются их своеобразные свойства.
Прошел год и новое, еще более необычное явление удивило мир. Беккерель во Франции обнаружил, что близкое соседство веществ, содержащих уран, вызывает почернение завернутых в светонепроницаемую бумагу фотопластинок. Новое явление было названо радиоактивностью. Им заинтересовались и стали его изучать многие физики, среди которых были супруги Мария и Пьер Кюри. После года напряженной работы им удалось выделить из урановой руды вещества, обладающие огромной радиоактивностью, в миллионы раз большей, чем уран. Это были новые элементы - радий и полоний.
Что же представляет собой радиоактивное излучение? Как связана радиоактивность со строением вещества? Новая загадка природы требовала объяснения.
Здесь следует сказать еще об одном свойстве радиоактивных лучей, которое помогло выяснить их природу. Радиоактивные лучи сильно ионизуют среду, через которую они проходят. Это означает, что отдельные молекулы вещества, попадающиеся на их пути, теряют электроны и становятся положительно заряженными ионами. Способностью к ионизации обладают также рентгеновские лучи и быстрые электроны. Используя эффект ионизации при изучении радия, физикам удалось установить, что излучение радия состоит из лучей двух видов, сильно различающихся по способности проникать сквозь вещество. Слабо проникающие лучи (они поглощаются полностью листом тонкой бумаги) были названы α-лучами. Лучи с большей проникающей способностью (чтобы их задержать, необходимо несколько миллиметров вещества), получили название β-лучей (α и β - первые буквы греческого алфавита).

Э. Резерфорд (1871-1937 г.)
Английский физик Э. Резерфорд (1871-1937 г.), с именем которого связаны замечательные открытия в области атомной физики, предположил, что α-лучи, вылетающие из радия, являются атомами какого-то уже существующего элемента. Чтобы проверить свою гипотезу, Резерфорду нужно было определить массу α-частиц. Для этого он производит следующий простой опыт. Над небольшой камерой А (рис. 1), на дне которой была положена радиоактивная соль В, помещался электроскоп D. Камера А была разделена на части параллельно поставленными близко друг к другу металлическими пластинами, α-частицы, проходя вдоль металлических пластин, вызывали ионизацию газа внутри электроскопа [рис. 1 (II)] и, следовательно, изменение его показаний. Когда включалось сильное магнитное поле, направленное вдоль пластин перпендикулярно чертежу, ионизация в камере электроскопа почти прекращалась. Это однозначно указывало на то, что α-лучи - поток заряженных частиц, отклоняемый магнитным полем на пластины. Чтобы определить знак заряда α-частиц, часть зазора между пластинами прикрывалась. При этом оказалось, что показания электроскопа зависят от направления магнитного поля [к читателю или от читателя. Рис. 1 (I) и (III)]. Ясно, что при отклонении потока частиц влево большая часть α-частиц попадает на пластины. Отсюда, зная направление отклонения α-лучей магнитным полем, нетрудно было определить знак заряда α-частиц, оказавшийся положительным. Наконец, создавая между пластинами электрическое поле, удавалось также, при определенном его значении, добиться отклонения α-частиц.
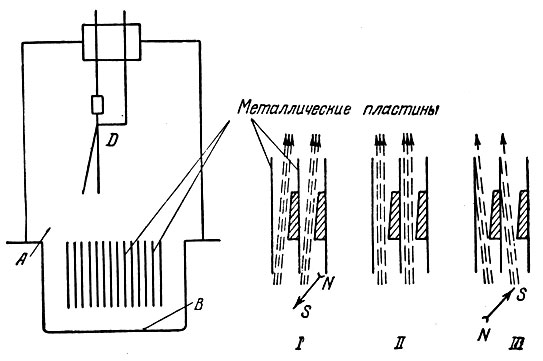
Рис. 1. Определение природы α-частиц Резерфордом. А - камера, В - радиоактивная соль, D - электроскоп. Справа показаны направления потока α-частиц при изменении направления магнитного поля
Данные этого опыта позволили определить скорость α-частиц, а также найти отношение их заряда к массе. Получалось, что α-частицы есть ионы гелия, несущие два положительных заряда, т. е. атомы гелия, лишенные двух электронов. Позднее, когда были получены более крупные количества радия (эти количества исчислялись граммами), Резерфорд окончательно доказал правильность своих выводов следующим красивым опытом. Газ, образованный α-частицами, прошедшими через очень тонкие стенки запаянной стеклянной трубки с эманацией радия (радоном), в течение двух суток собирался в разрядной трубке А (рис. 2). Поднятием уровня ртути газ был сжат и переведен в капилляр V. Создавая в капилляре электрический разряд, можно было в спектре излучения газа обнаружить характерные желтые линии гелия.
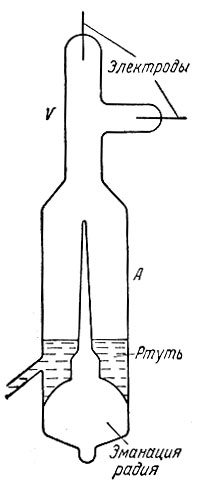
Рис. 2. Опыт Резерфорда, доказавший существование радиоактивного распада элементов
Была выяснена также природа β-лучей. Они оказались очень быстрыми электронами, летящими почти со скоростью света. Существует также третий вид радиоактивного излучения, названный γ-лучами. γ-лучи - электромагнитные волны, еще более короткие, чем рентгеновские.
Наряду с изучением состава радиоактивного излучения проводились химические исследования радиоактивных элементов. Они показали, например, что металлический радий, помимо гелия, образует тяжелый радиоактивный газ (радон), по своим химическим свойствам близкий к инертным газам неону и аргону. Опираясь на эти опытные факты, Резерфорд и Содди в 1903 г. выдвинули теорию радиоактивного распада. Согласно этой теории, радиоактивность есть самопроизвольное превращение одних элементов в другие. Атом, испустивший β- или β-частицу, уже не является атомом первоначального элемента.
Это открытие означало подлинный переворот в науке. Атомы, считавшиеся незыблемой основой матеоии, оказались неустойчивыми. Время от времени они взрываются, испуская летящие с огромной скоростью частицы и превращаясь при этом в новые атомы. Замечательной особенностью радиоактивного распада является полная независимость его от внешних условий: ни тысячеградусная температура, ни высокие давления не способны повлиять на скорость распада радиоактивного вещества. Время, за которое распадается половина первоначально имевшихся атомов, называется периодом полураспада данного вещества. Мерой скорости распада ядер нельзя выбрать время, за которое распадаются все ядра радиоактивного элемента. Наблюдаемый закон распада (он называется экспоненциальным) таков, что потребовалось бы бесконечно долго ждать полного распада радиоактивного вещества. Скорость распада элементов резко различна: для одних периоды полураспада исчисляются тысячелетиями (радий - 1600 лет) и даже миллиардами лет (торий - 14 миллиардов лет, уран - 4,6 миллиарда лет), другие распадаются почти мгновенно, за миллионные доли секунды.
В природе известны три не связанных друг с другом ряда взаимно превращающихся радиоактивных элементов (рис. 3). В каждом из них происходит последовательный распад элементов либо с испусканием α-частицы, либо с вылетом электрона (β-частицы). Во всех радиоактивных рядах - семействах - последним, уже устойчивым, нераспадающимся элементом является свинец, точнее, три его разновидности - изотопа.
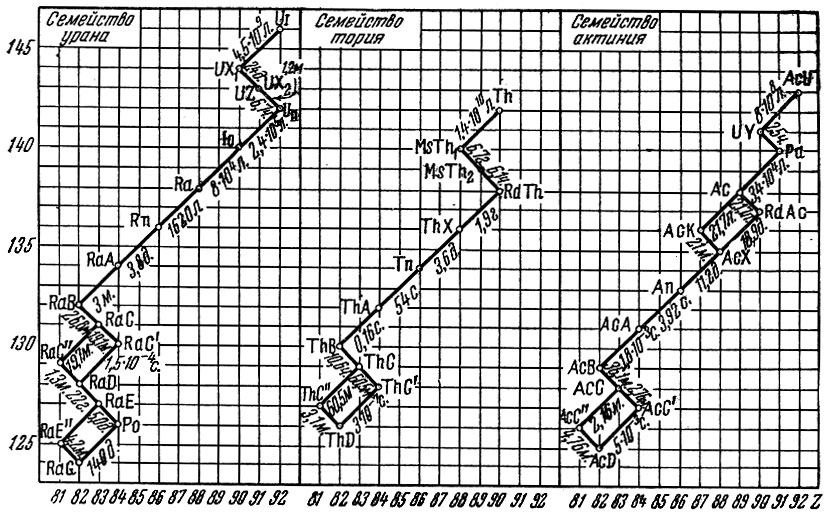
Рис. 3 . Ряды распада радиоактивных элементов
Изучение радиоактивности показало, что существуют вещества, которые обладают одинаковыми химическими свойствами, но различаются периодом полураспада и энергией вылетающих частиц. Они были названы изотопами, что означает по-гречески "занимающие одинаковое место", потому что все изотопы данного элемента помещаются в одной клетке менделеевской таблицы. Выяснилось также, что изотопы существуют и у стабильных элементов. Природа этого явления стала понятной только после открытия нейтрона. Встречающиеся в природе элементы представляют собой обычно смесь нескольких различных изотопов. Конечным продуктом ряда урана, начинающегося изотопом урана с атомным весом 238, является свинец с атомным весом 206. Ряд тория заканчивается изотопом свинца-208. Наконец, ряд актиния начинается с урана-235 и заканчивается изотопом свинца-207.
"После того, как ряды естественных превращений урана и тория были изучены, можно было надеяться, что когда-нибудь нам удастся найти методы разрушения устойчивых атомов некоторых обыкновенных элементов. Для того чтобы приступить к штурму этой проблемы с какими-то шансами на успех, необходимо было получить некоторое представление о строении атомов",- писал позже Резерфорд.
Открытие радиоактивности навело Резерфорда на мысль исследовать строение атомов путем бомбардировки их α-частицами радия. Он предполагал, что наблюдение за рассеянием α-частиц отдельными атомами сможет дать ценные сведения о природе и интенсивности отклоняющего поля внутри атома. Но наблюдение ионизации при помощи электроскопа не позволяло фиксировать пути отдельных частиц. Был найден новый способ регистрации быстрых частиц, также основанный на возбуждении и ионизации атомов. При изучении свойств радиоактивных лучей физики заметили, что некоторые вещества светятся - люминесцируют - в присутствии радиоактивных веществ. Наблюдение под микроскопом одного из таких веществ, облучаемого α-частицами, неожиданно показало, что сплошное свечение, видимое невооруженным глазом, является наложением отдельных вспышек (сцинтилляций), возникающих, очевидно, в тех местах, куда попадают α-частицы. По этим сцинтилляциям можно было определить направление рассеяния отдельных α-частиц.
Найдя подходящий способ наблюдения рассеяния α-частиц, Резерфорд поручил молодому ученому Марсдену, приехавшему работать к нему в лабораторию, посмотреть, как будет изменяться направление движения α-частиц после прохождения их сквозь очень тонкую золотую фольгу. Экспериментальная установка состояла из радонового источника R, α-частицы от которого проходили через диафрагму D и падали узким пучком на тонкую фольгу F (рис. 4). Рассеянные фольгой α-частицы ударялись об экран,покрытый сернистым цинком. Сцинтилляции, возникавшие на экране о, наблюдались в микроскоп М. Микроскоп и экран можно было поворачивать в плоскости чертежа относительно оси, проходящей через точку О перпендикулярно чертежу. При различных углах 6 считали число вспышек, возникающих на экране в определенный промежуток времени. Вот как происходили эти необычные опыты.
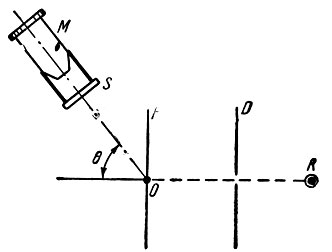
Рис. 4. Установка для наблюдения рассеяния α-частиц на золоте. R - источник частиц, D - диафрагма, F - фольга из золота, S - сцинтиллирующий экран, M - микроскоп
Наблюдение сцинтилляций было очень трудной работой. Экспериментатор должен был в течение полутора часов привыкать к темноте. Только после этого глаз его начинал видеть в микроскоп вспышки. Во время счета их в соседней комнате сидел второй сотрудник, который вел запись опыта. Когда в установке нужно было произвести изменения, наблюдатель прикрывал глаза, в комнате зажигался свет и второй экспериментатор входил в нее, делал необходимую перестановку, гасил свет и измерения продолжались. В современных условиях очень чувствительные фотоумножители с успехом заменили бы наблюдателя в описанных выше опытах.
Каковы же были результаты опытов Марсдена, которые он проводил совместно с Гейгером? Казалось, что они подтверждали представление об атоме, предложенное Томсоном. Но была в опытах по рассеянию одна удивительная особенность. Хотя подавляющая часть α-частиц отклонялась от первоначального направления на небольшие углы порядка 1°, как это и ожидалось, изредка (в одном случае на несколько тысяч) наблюдались отклонения на очень большие углы, 90° и более, так что некоторые α-частицы как бы отскакивали назад от фольги. Многие физики знали об этом необычном факте. Но только Резерфорд оценил его исключительную важность. Опыты по рассеянию α-частиц, по его мнению, указывали на существование в атоме огромных сил. Непонятно было, за счет чего эти силы возникают.
Нам сейчас нетрудно убедиться в правильности сомнений Резерфорда. Легко показать, что, исходя из модели атома Томсона, практически нужно совершенно исключить большие отклонения α-частиц. В атоме Томсона- сплошном шаре радиусом 10-8см с равномерно распределенными положительными и отрицательными зарядами - отсутствуют силы, могущие вызвать отскок α-частицы назад.
Рассмотрим α-частицу с массой М, обладающую скоростью v и положительным зарядом, равным 2е, где е - заряд электрона (е = 4,8*10-10 CGSE). В атоме золота, на котором рассеивается α-частица, имеется Z электронов и положительный заряд Ze, связанный почти со всей массой атома. Значительное отклонение α-частиц может быть обусловлено только действием обладающего большой массой положительного заряда атома. Если распределение положительных и отрицательных зарядов равномерно, то величина нескомпенсированного положительного заряда должна быть примерно равна е, а линейные размеры его соответствовать среднему расстоянию между электронами 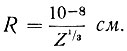 . Угол рассеяния α-частицы θ1 примерно равен отношению импульса, переданного α-частице, к первоначальному импульсу (он равен произведению ее массы и скорости). С другой стороны, импульс, переданный α-частице, равен действующей на нее силе F, умноженной на время ее взаимодействия Т с некомпенсированным зарядом
. Угол рассеяния α-частицы θ1 примерно равен отношению импульса, переданного α-частице, к первоначальному импульсу (он равен произведению ее массы и скорости). С другой стороны, импульс, переданный α-частице, равен действующей на нее силе F, умноженной на время ее взаимодействия Т с некомпенсированным зарядом
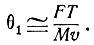
Согласно закону Кулона, сила взаимодействия
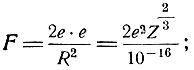
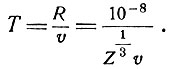
Откуда 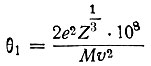 (в радианах). Если подставить в это выражение значения М = 6,6*10-24г, v = 109см/сек и Z = 79 (золото), то θ1 = 3,0*10-5радиан или 0,0017°.
(в радианах). Если подставить в это выражение значения М = 6,6*10-24г, v = 109см/сек и Z = 79 (золото), то θ1 = 3,0*10-5радиан или 0,0017°.
В фольге толщиной 5*10-5см, примененной в опыте, на 1 см2 приходится ~3*1018 атомов золота. Отсюда, зная поперечное сечение атома (πD2/4), мы найдем число столкновений, которое испытает α-частица. Оно будет равно в среднем 230. Из теории вероятности следует, что при n случайных столкновениях суммарное отклонение 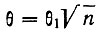 или около 0,02°. Вероятность отклонения на большие углы, составляющие десятки градусов, оказывается совершенно ничтожной.
или около 0,02°. Вероятность отклонения на большие углы, составляющие десятки градусов, оказывается совершенно ничтожной.
Таким образом, результаты опытов по рассеянию α-частиц указывали на ошибочность господствовавших в то время представлений о строении атома. Основываясь на опытных фактах, Резерфорд создал новую теорию строения атома. Он высказал смелое предположение о том, что весь положительный заряд, а следовательно, и почти вся масса атома сосредоточены в очень малой части атома в его центре. Радиус этой части атома, названной ядром, составляет менее чем 10-12см, т. е. в десятки тысяч раз меньше размеров всего атома. Новая модель атома объясняла появление α-частиц, летящих в обратном направлении. Это были те частицы, которые проходили очень близко от ядра и испытывали сильнейшее отталкивание со стороны ядра. Ведь сила электростатического взаимодействия обратно пропорциональна квадрату расстояния между зарядами, поэтому сближение увеличивало отталкивание в миллионы раз. Некоторое, правда, очень грубое представление о явлениях при рассеянии может дать механическая модель, изображенная на рис. 5. Чтобы отклониться на большой угол, α-частица должна пройти вблизи ядра, сечение которого составляет ничтожную часть от площади сечения, занимаемого атомом.
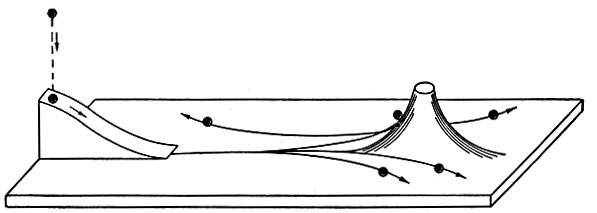
Рис. 5. Механическая модель рассеяния α-частиц атомным ядром. Шарики, летящие точно в направлении на горку, отклоняются на большие углы. Остальные шарики почти не изменяют своего направления
Если в рассмотренном выше примере столкновения α-частицы с атомами золота заменить атом в виде шара с равномерно распределенным зарядом атомом по Резерфорду, то можно найти, как близко от ядра должна пройти α-частица, чтобы отклониться на 90°.
Для такого отклонения импульс, переданный α-частице, должен быть близок ее собственному импульсу Mv. Приравнивая, как и раньше, переданный импульс произведению FT, где
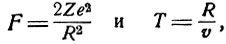
найдем
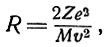
откуда после подстановки соответствующих цифровых величин получим R = 5,5*10-12см. Радиус ядра, естественно, должен быть меньше этого значения. Вероятность отклонения на 90° найдем, взяв отношение суммы площадей πR2 для всех атомов золота, содержащихся в 1 см2 фольги к 1 см2; полученное значение 0,0003 означает, что из 3000 α-частиц только одна отклонится столь сильно. Примерно то же наблюдается на опыте.
Таким образом, созданная Резерфордом теория рассеяния, в которой он рассматривал электростатическое взаимодействие двух точечных зарядов, дала прекрасное количественное согласие с опытными данными. Более того, на основании этой теории из опытов по рассеянию α-частиц удалось, позднее, непосредственно определить величину заряда ядра. В пределах ошибок он совпал с атомным номером Z.
Но где же в атоме располагаются электроны? Резер-форд предположил, что они движутся вокруг ядра по круговым орбитам различных радиусов. При этом устойчивость движения электронов определяется тем, что электростатическое притяжение их к ядру как раз компенсируется центробежной силой, возникающей при вращении. Эта модель атома очень напоминает солнечную планетную систему, в которой планеты заменены электронами, а Солнце - ядром. Отличие, не говоря, конечно, о размерах, заключается в природе сил, действующих в системах. В атоме - это электростатические силы, в солнечной системе - это силы всемирного тяготения.
Планетарная модель атома поначалу не была признана. Основным доводом против нее была несовместимость устойчивого движения электрона вокруг ядра с классическими законами электричества. Электрон, движущийся с ускорением около ядра, неминуемо должен терять часть своей энергии посредством излучения, как это происходит, например, в радиоантенне или в рентгеновской трубке. Потеря энергии электрона в атоме должна вызвать уменьшение его кинетической энергии и падение на ядро.
В 1913 г. в поддержку планетарной модели атома выступил датский физик Н. Бор. Он высказал гениальную идею о существовании у атома устойчивых стационарных состояний, в которых электрон не излучает энергию. Каждое из этих состояний характеризуется строго определенной энергией, а излучение и поглощение энергии в виде света происходит только при переходе атома из одного состояния в другое. Этому переходу соответствует перескок электрона с одного уровня на другой.
В своей теории Бор использовал представления о прерывности энергии в микромире. В начале XX в. Планком было установлено, что свет, обладающий определенной длиной волны, не может испускаться и поглощаться сколь угодно малыми порциями, что существуют минимальные количества энергии - так называемые кванты. Правильность этого крайне важного открытия вскоре подтвердилась при изучении фотоэффекта, т. е. явления испускания электронов при поглощении света атомами. Таким образом, в одних опытах, как, например, дифракция, проявлялась волновая природа света, в других - квантовая. В этих последних свет вел себя как поток прямолинейно распространяющихся частиц. Позднее было выяснено, что подобная двойственность присуща также и частицам, например электронам. Эти открытия послужили основой для создания квантовомеханической теории.
Новая теория показала, что представления Бора о существовании в атоме электронных орбит неверны. Оказалось, что такие понятия, как орбита, траектория, вообще неприменимы к электрону в атоме. Квантовая механика показала, что может быть определена лишь вероятность нахождения электрона в любой точке атома. Эта вероятность характеризует распределение электрического заряда в атоме или распределение электронного облака вокруг ядра. На рис. 6 и 7 изображены рассчитанные теоретически распределения электрического заряда в атоме водорода при различных его состояниях.

Рис. 6. Распределение электрического заряда в атоме водорода. Основное состояние

Рис. 7. Распределение электрического заряда в атоме водорода. Первые возбужденные состояния
|
ПОИСК:
|