
3. Электромагнитные силы в электрически нейтральных телах
Атом
"Дайте мне запас электронов, и я немедленно построю вам с помощью кулоновских сил атом", - могло бы сказать с полным правом атомное ядро,... если бы умело разговаривать. Ведь именно эти силы удерживают электроны у положительно заряженного ядра. Если оголить ядро, сорвав прикрывающие его электроны, то электрическое поле ядра немедленно начнет захватывать пролетающие возле него свободные электроны и будет их захватывать до тех пор, пока число электронов не станет равным заряду ядра. Как только система электрон - ядро становится нейтральной, построение атома закончено.
Основы строения атома сейчас стали азбучной истиной. В центре атома расположено ядро, в котором сосредоточена почти вся масса атома, а вокруг ядра движутся электроны.
Атом мал и крайне пуст внутри, если не считать заполняющего его электрического поля. Гораздо более пуст, чем наша солнечная система, размеры которой в сотни раз превосходят размеры самого Солнца и в десятки тысяч раз размеры планет. Если бы атом внезапно вырос до размеров земной орбиты, то ядро оказалось бы в тысячу раз меньше Солнца. А ведь уменьшись наше Солнце в тысячу раз, мы видели бы на небе светящуюся точку вместо сверкающего диска.
Часто говорят и сейчас, а раньше были в этом твердо уверены, что электроны движутся вокруг ядра по определенным орбитам, подобным орбитам планет солнечной системы. Ведь электростатические силы вполне аналогичны по своему характеру силам всемирного тяготения. Разница лишь в том, что сила взаимодействия "планет" атомной системы (электронов) друг с другом не очень значительно отличается от силы взаимодействия их с ядром, в то время как в солнечной системе только притяжение к Солнцу велико. Взаимодействие планет вносит малые поправки. Заряд самого тяжелого ядра не превышает заряда электрона более чем в 100 раз. Масса же Солнца в миллион раз больше массы планет. Наконец, электроны отталкивают друг друга, а планеты притягивают.
Но не в этом заключено то колоссальное различие, которое имеется в строении атома и солнечной системы.
Нераскрытая пока до конца тайна происхождения солнечной системы хранит в себе причины определенных размеров орбит планет солнечной системы. Мы легко можем допустить, что они могли бы быть иными. Да что говорить, ведь сейчас люди сами создают маленькие планеты, и их орбиты мы можем выбирать произвольно, придавая ракете определенную скорость.
Совершенно не то в атоме. Его свойства, а следовательно и строение, совершенно не зависят от происхождения. Все атомы данного химического элемента тождественны, независимо от того, существуют ли они с незапамятных времен или же возникли буквально на наших глазах путем захвата электронов только что изготовленным ядром. Заставить электрон двигаться в атоме так, как мы хотим, невозможно.
Все дело в том, что ядро строит атом посредством своего электрического поля не по правилам механики Ньютона, не по правилам электродинамики Максвелла. Построить атом, который бы жил по этим законам, вообще невозможно.
Электроны в атоме, разумеется, не могут двигаться по прямой. Они двигаются с ускорением и, следовательно, должны излучать электромагнитные волны. Излучение сопровождается потерей энергии, поэтому электроны неизбежно должны упасть на ядро, подобно тому как спутник, в верхних слоях атмосферы теряя энергию вследствие сопротивления воздуха, рано или поздно падает на Землю. Разница в том, что спутник может кружиться годами, а электрон, если следовать классической теории, не более миллионной доли секунды. Кратковременная вспышка света засвидетельствовала бы гибель атома. Электромагнитное поле классической физики должно было бы губить атом, хотя оно же и создает его. Совсем как Тарас Бульба своего сына: "Я тебя породил, я тебя и убью".
В действительности же ничего подобного не происходит. Ёсли обращаться с атомом не слишком грубо, то он может существовать сколь угодно долго. Природа поступила очень мудро, подчинив движение микрочастиц квантовым законам. Выполняя квантовые правила поведения, атом избегает гибели, подобно тому как водители машин избегают несчастных случаев, выполняя правила уличного движения. Но только квантовые правила внутриатомного движения - это закон природы, нарушить который ни электрон, ни что другое в мире не может. Суть этих правил в том, что энергия электрона в атоме может иметь только определенный ряд прерывных значений, не может изменяться постепенно, и электрон не может непрерывно излучать. Всегда имеется минимальное значение энергии, которую атом не теряет ни при каких условиях, если только ему удается сохранить свою электронную оболочку.
Об излучении речь пойдет впереди. Для понимания дальнейшего важно, что движение электрона в атоме почти ничего общего не имеет с движением планет по орбитам. Если бы атом водорода в наинизшем энергетическом состоянии (простейшая система) можно было бы сфотографировать с большой выдержкой, то мы увидели бы облако с максимальной плотностью на определенном расстоянии от ядра. Это расстояние можно принять за грубое подобие радиуса орбиты. Фотография атома совсем не походила бы на привычный рисунок солнечной системы, а скорее напоминала бы расплывчатое пятно, полученное при фотографировании ночной бабочки, беспорядочно толкущейся вокруг фонаря*.
*(Здесь нужно иметь в виду сходство картин только в среднем за время выдержки. Движение электрона никак нельзя отождествлять с порханием бабочки, равно как и с движением любого другого макроскопического тела.)
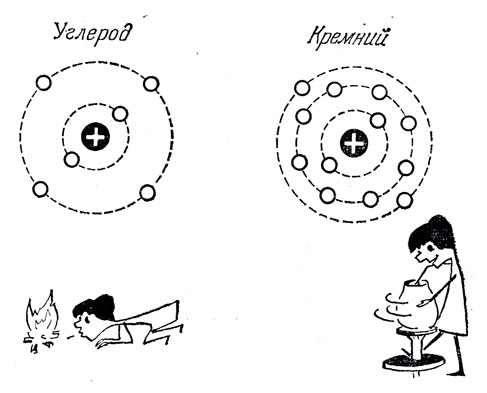
О строении сложных атомов нам нужно твердо запомнить следующее. Электроны в атомах располагаются слоями или, как говорят, оболочками. Число вакантных мест в каждом слое строго ограничено. В ближайшей к ядру внутренней оболочке их может быть только два, в следующей уже 8, и т. д. Чем дальше от ядра, тем больше дозволенное количество электронов, но оно всегда остается ограниченным. Не электрические силы диктуют это, а жесткие квантовомеханические правила. Это требование принципа Паули, суть которого в том, что нельзя электронам, тождественным по своим свойствам, быть еще тождественными по состоянию. "Хоть чем-нибудь, но отличайтесь друг от друга"! - вот приказ природы.
Электроны в атомах
Увеличение числа электронов в атоме и образование новых слоев, заполненных электронами, не сопровождается расширением атома. Увеличение положительного заряда атомного ядра вызывает сжатие внутренних оболочек. Таким образом, размеры всех атомов, определяемые радиусами внешних слоев, оказываются примерно одинаковыми, а внутренние электроны все теснее и теснее примыкают к ядру по мере увеличения его заряда.
Эти закономерности в строении атомов проявляются в полной мере, когда атомы встречаются друг с другом. При встрече они соприкасаются своими внешними оболочками, и то, что происходит в глубинах атома, оказывается не таким уж существенным. Главное - сколько электронов на периферии атома. Их число целиком, практически, определяет те "намерения", которые обнаруживают атомы при сближении: сцепиться ли им друг с другом или разойтись восвояси. Можно смело утверждать, что встречают друг друга атомы исключительно по одежке, хотя сама "одежка" определяется сердцевиной атома - ядром.
Число внешних электронов меняется периодически по мере увеличения заряда ядра. После застройки одной оболочки начинается строительство новой, уже дальше от ядра. В этом ключ к разгадке физического смысла периодической системы элементов Менделеева. Ведь химические свойства атома определяются числом внешних, наименее связанных с ядром электронов.
Нетрудно понять, что чем меньше электронов содержит внешняя оболочка, тем слабее они связаны с ядром. Внутренние электроны вместе с ядром можно, грубо говоря, рассматривать как положительный ион. Если внешняя оболочка имеет лишь один электрон (типичные металлы: литий, натрий и др.), то он притягивается зарядом иона, равным единице в атомной системе единиц.
При двух электронах в наружном слое (бериллий, кальций и т. д.) каждый из них притягивается к центру с силой в два раза большей, ибо электрический заряд остальной части атома равен двум, и т. д. С увеличением числа внешних электронов увеличивается заряд положительного иона, сила притяжения электронов возрастает, радиус орбит уменьшается и прочность связи растет. Связь наиболее прочна, когда внешняя оболочка целиком заполнена. Это имеет место у инертных газов: гелия, неона, аргона и других. Число электронов во внешней оболочке равно двум у гелия и восьми у всех остальных.
Атомное ядро
В атоме электрические силы являются главными. Внутри ядра им принадлежит выдающаяся, но уже не основная роль. Заряженные положительно протоны ядра расположены чрезвычайно близко друг к другу и поэтому не могут не взаимодействовать. С громадной силой они отталкиваются друг от друга, и не будь более мощных ядерных сил, ядро не могло бы существовать. Со скоростями, близкими к скорости света, протоны разлетелись бы в разные стороны.
Мощные кулоновские силы отталкивания делают ядро подобным сжатой пружине, стремящейся распрямиться. У атомов тяжелых элементов протонов так много (у урана их 92), что ядра становятся неустойчивыми. Ядерные силы притяжения, которые в легких ядрах совершенно подавляют электрическое отталкивание, в уране с трудом противостоят ему. Достаточно незначительного толчка (попадания нейтрона) и ядро разваливается на две половины, разлетающиеся под действием сил отталкивания с огромными скоростями. Именно за счет работы электрических сил выделяется энергия в атомном реакторе и при взрыве атомной бомбы. Так называемая ядерная энергия, выделяемая здесь, это в сущности энергия электромагнитная.
Два типа сил между атомами
Доказать существование значительных сил между нейтральными атомами (или молекулами) совсем не сложно. Попробуйте-ка сломать толстую палку! А ведь она состоит в конечном счете из атомов. Два типа электрических сил совершенно разной природы могут действовать между атомами. Один из них имеет простой аналог во взаимодействии больших тел и "вполне добропорядочен", ибо является классическим в своей основе.
Другой тип - это квантовомеханические силы, часто называемые обменными. Их можно рассчитать с помощью квантовой механики, но если попытаться создать наглядную картину возникновения этих сил, то с неизбежностью эта картина окажется неполной. Происходящее в атоме нельзя целиком описать языком классической физики, т. е. единственно наглядным научным языком для людей, весь повседневный опыт которых есть опыт созерцания явлений, подчиняющихся классической физике.
На больших расстояниях между атомами действуют только классические силы. В этом случае взаимодействие атомов проявляет, несомненно, если не полное, то достаточно заметное пренебрежение к деталям строения самих атомов. Как взаимодействие отдельных атомов, так и взаимодействие групп атомов, объединенных в молекулы, подчинено одному закону. Именно поэтому данный тип сил носит название молекулярных. Ведь атом можно считать частным случаем молекулы, ее простейшей формой. Иногда эти силы называют силами Ван-дер-Ваальса по имени голландского ученого, который впервые ввел их в теорию газов и применил для объяснения перехода газов в жидкое состояние.
На значительных расстояниях ни атомы, ни молекулы не отталкиваются. Удаленные соседи всегда стремятся друг к другу. Молекулярные силы на большом расстоянии - это силы притяжения.
Обменные силы возникают при сближении атомов, когда их внешние оболочки начинают соприкасаться. Здесь уже полностью проявляется индивидуальность встретившейся пары. Атомы либо образуют устойчивую систему - молекулу, либо же энергично отталкиваются.
Объединение атомов в молекулы - это уже химия. Поэтому квантовомеханические силы сцепления часто называют химическими.
Если попытаться сблизить атомы на расстояние, меньшее суммы их радиусов, то между ними обязательно возникнут силы отталкивания. Вогнать один атом внутрь другого не удастся.
Надо подчеркнуть, что в основе как молекулярных сил, так и химических лежит электростатическое взаимодействие. Магнитные силы сколько-нибудь существенной роли не играют.
Сейчас мы познакомимся с обоими типами сил несколько более подробно.
Молекулярные силы
Как возникает молекулярное притяжение между электрически нейтральными системами? Сначала постараемся понять, почему клочки бумаги или другие легкие предметы притягиваются к наэлектризованному телу.
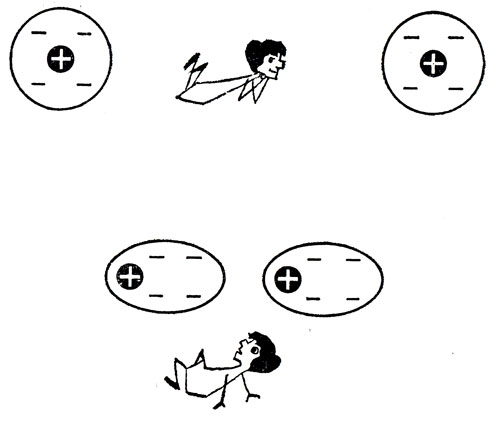
Вот положительно заряженный стержень приближается к бумажной полоске. Заряженные частицы атомов бумаги не могут остаться к этому равнодушными. Электроны смещаются навстречу положительному заряду, а ядра отступают немного назад. Происходит то, что физики называют поляризацией. Отрицательный заряд оказывается ближе к наэлектризованному телу, чем положительный, и сила притяжения получает перевес над силой отталкивания.
Если вместо бумажного клочка была бы одна только молекула, с ней произошло бы то же самое. Электрическое поле подобно ветру сдувает легкие электроны немного в сторону от ядер, и молекула превращается в электрический диполь, в котором заряды противоположных знаков пространственно разделены.
У многих веществ, например у воды, молекулы при своем рождении сразу же оказываются подобными электрическому диполю. Такие молекулы своим электрическим полем вызывают поляризацию соседей и появление сил притяжения.
Лишь в том случае, когда электронное облако каждого из атомов имеет полную шаровую симметрию, между ними не возникнут силы притяжения. Однако в действительности только в среднем за большое время можно утверждать, что "центр тяжести" отрицательного заряда находится в ядре изолированного атома. В данный момент электрон (если говорить для простоты об атоме водорода) может быть обнаружен в любой точке на расстоянии около 10-8 см от ядра. При сближении с другим атомом электрическое поле системы электрон - ядро возмущает движение электрона соседнего атома таким образом, что "центр тяжести" отрицательного заряда атома оказывается смещенным относительно ядра. Каждый атом (или молекула) поляризует своего соседа, и они начинают притягиваться друг к другу.
Молекулярные силы
Это взаимодействие в основе своей является кулоновским. Но так как притяжение между нейтральными системами - следствие некоторого преобладания над существующим одновременно отталкиванием, и так как степень поляризации систем резко ослабевает с увеличением расстояния, то эти силы значительно слабее чисто кулоновских и гораздо быстрее убывают с расстоянием. Если у изолированной молекулы положительный и отрицательный заряды пространственно не разделены, то силы притяжения обратно пропорциональны не квадрату, а седьмой степени расстояния. При увеличении расстояния в два раза сила ослабевает не в 4, а в 128 раз! Поэтому эти силы практически уже не сказываются, если расстояние в 10 раз превышает размеры самих молекул. Силы Ван-дер-Ваальса являются короткодействующими.
Химические силы
О том, что химические силы имеют электромагнитную природу, догадывался еще Фарадей. "Атомы материи, - писал он, - каким-то образом одарены электрическими силами или связаны с ними, и им они обязаны своими наиболее замечательными качествами и в том числе своим химическим сродством друг с другом". В настоящее время электрическая природа химических сил строго доказана.
Силы Ван-дер-Ваальса не способны объяснить образования молекул. Прежде всего для этого они слишком слабы. Но не это главное. Химическая связь, подобно тесной дружбе между людьми, обладает необычайным свойством насыщения. Атом водорода может присоединить к себе только один такой же атом, но ни в коем случае не два и не три. Атом углерода способен связать четыре атома водорода, но не более, и т. д. Это свойство с самого начала представляется загадочным. Ни один тип сил, с которыми мы имели дело до сих пор, не обладал свойством насыщения. Звезда, например, подобно оратору, который может взаимодействовать с аудиторией любой величины, способна притягивать к себе любое число планет. Сила, действующая на одну из них, никак не зависит от наличия остальных. Не знают насыщения электромагнитные силы между заряженными частицами. Не знают его и силы молекулярного притяжения.

Химические силы
Свойство насыщения выражается в химии понятием валентности, которое было введено еще задолго до того, как ученые смогли приступить к выяснению природы химических сил.
Химическую связь в самых общих чертах можно объяснить как результат коллективизации внешних (валентных) электронов двух соединяющихся атомов. При определенных расстояниях между ядрами коллективизированные электроны, проходя между ядрами, компенсируют отталкивание последних. На больших расстояниях коллективизация не возникает и действуют только силы Ван-дер-Ваальса. Насыщение обусловлено ограниченным числом коллективизируемых электронов.
В простейшей молекуле - молекуле водорода - оба электрона ведут себя так, как если бы каждый электрон проводил часть времени возле одного ядра, а часть - возле другого. Именно поэтому возникающие вследствие коллективизации электронов силы называются часто обменными. Однако не следует слово "обмен" понимать слишком буквально, как колебания электронов от одного протона к другому. Такой наглядности, свойственной классической механике, нет. Истинный смысл обменного эффекта состоит в одновременной коллективизации двух электронов двумя одинаковыми ядрами.
Форма электронного облака молекулы водорода (Н2) сильно отличается от сферически симметричного облака изолированных атомов. Получающаяся картина несколько напоминает делящуюся биологическую клетку до ее полного разделения.
Атомные ядра соответствуют ядрам дочерних клеток, а электронный заряд - протоплазме*. Протоплазменный тяж удерживает клетки друг возле друга, пока процесс деления не завершится. В случае молекулы ту же роль играет тяж из "электронной протоплазмы". Она вызывает взаимное притяжение ядер кулоновскими силами, как если бы некоторая часть отрицательного электрического зяряда была сосредоточена между ними. При не слишком малых расстояниях между ядрами силы, вызванные коллективизацией электронов, с избытком компенсируют отталкивание ядер. При очень малых расстояниях часть заряда, сосредоточенная между ядрами, становится недостаточной. Электроны как бы выталкиваются из промежутка между ядрами во внешнюю область, и расталкивание ядер уже не компенсируется.
*(Здесь и в дальнейшем мы используем очень образное изложение природы химических сил, принадлежащее советскому физику Я. И. Френкелю.)
Как притяжение, так и отталкивание получает, таким образом, полное объяснение.
При соединении различных атомов обобществленные электроны движутся несимметрично по отношению к обоим ядрам. В особенно резкой форме это имеет место у так называемых гетерополярных* (разнородных) молекул, таких как поваренная соль (NaCl), соляная кислота НСl и др. У поваренной соли, например, связь осуществляется коллективизацией восьми валентных электронов: одного у натрия и семи у хлора. Так как остаточный заряд хлора больше, то все коллективизированные электроны сильно сдвигаются к иону хлора, и коллективизация выглядит как экспроприация одного электрона более "сильным" атомом у более "слабого". Последний становится, грубо говоря, положительным ионом, а первый - отрицательным, и химическая связь сводится к притяжению разноименных зарядов.
*(В отличие от гомеополярных (однородных) молекул, таких, как молекула водорода.)
Распределение электронов утрачивает полярный характер по мере уменьшения различия ядер, становясь совершенно симметричным в случае одинаковых атомов.
Молекулу нельзя представлять себе как сумму неизменных атомов, удерживаемых в равновесии силами притяжения и отталкивания. Это представление Берцелиуса 150-летней давности является грубо упрощенным.
Междуатомной связи нет в молекуле, потому что не существует атомов, которые могли бы объединиться в молекулу, оставаясь неизменными. Так, в молекуле водорода, строго говоря, нет атомов водорода, их индивидуальность растворяется при слиянии в новую систему. В ней содержится только "сырой материал", из которого они могут быть построены: два протона и два электрона. В этом коренное отличие химических сил от всех сил, с которыми мы познакомились ранее. Молекулу нужно рассматривать как сумму ядер, экранированных внутренними электронами, и коллективизированных внешних электронов, движение которых зависит от расстояния между ядрами.
Спин элементарных частиц
Теперь нам осталось уяснить подробнее последний важный момент: что определяет валентность атома? Здесь нам придется предварительно познакомиться с еще одним фундаментальным свойством элементарных частиц, о котором еще не было сказано ни слова. Это так называемый спин. Именно спин в сочетании с принципом Паули позволил Гайтлеру и Лондону в Англии построить квантовую теорию химической связи и объяснить валентность.
Спин наглядно соответствует как бы "собственным вращениям" частиц. Было бы, однако, наивно представлять себе что-то вроде волчков, вращающихся вокруг своей оси. Не нужно забывать, что частицы вовсе не шарики и вообще не тот объект, портрет которого мог бы написать самый изощренный художник. Во всяком случае художник-натуралист. Наши наглядные представления хороши для мира "больших вещей", для макромира, но мало чем могут помочь, когда мы начинаем изучать явления микромира.

Спин элементарных частиц
Здесь вы, с удивлением прочитав и то, что спин связан с собственным вращением, и то, что одновременно ни о каком наглядном механическом вращении частиц говорить нельзя, можете почувствовать, что с вами обращаются дурно, и спросить в упор: а что же такое спин?

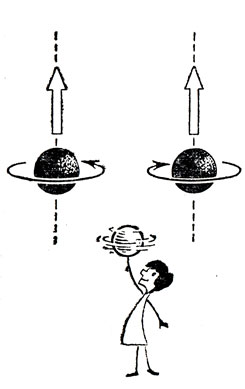
Вращательный момент
Если из ствола нарезного ружья вылетает пуля, то она на лету вращается вокруг продольной, т. е. совпадающей с направлением полета, оси. Представьте теперь себе момент охоты очень сильно закрученными пулями (нечто в духе Мюнхаузена). Засевшая в мишени пуля сообщит ей свое вращение и мишень начнет вращаться в ту же сторону, что и пуля. Физики говорят, что вращательный момент, который первоначально был только у пули, распределился между пулей и мишенью, в которой она застряла. Вращательный момент системы тел не может сам по себе, без воздействия со стороны, ни увеличиваться, ни уменьшаться. Это составляет суть закона сохранения вращательного момента или момента количества движения. Однако дело не в терминах. Для нас они не так уж важны. Не понадобится нам и точная формулировка этого важнейшего закона сохранения, по праву занимающего место рядом с законами сохранения энергии и количества движения. Важно усвоить только то, что по вращению мишени можно (причем точно, количественно!) судить о бывшем вращении пули.
А теперь представьте себе, что мишень обстреливается электронами или другими элементарными частицами и поглощает их. Если все частицы закручены в одну сторону, то, поглощаясь, они должны сообщить вращение мишени. Так вот, чем больше спин, тем сильнее начнет вращаться мишень.
Нет нужды пытаться бесплодно искать объяснение спина в каких-либо механических картинках. В опытах с мишенью мы имеем принципиальную схему того, как этот спин можно измерять, а это уже очень много. Конечно, мы коснулись лишь самой поверхности явления - за ней скрываются сложнейшие особенности законов движения и взаимодействия элементарных частиц... Однако уже эта внешняя сторона позволяет сравнивать спины различных частиц и дает тем самым некоторое представление о новом свойстве объектов микромира.
Разумеется, описанный нами опыт с мишенью является весьма грубым подобием реальных экспериментов, но мы не будем усложнять наш рассказ излишними деталями.
Итак, представьте себе, что мишень - пусть этой мишенью будет обычная копеечная монета - обстреливается из ружья, стреляющего элементарными частицами, Закрученными в одну сторону. Здесь выявится замечательное обстоятельство. При равном числе попаданий целый ряд частиц - электроны, протоны, нейтроны и некоторые другие - передадут мишени одинаковый момент количества движения. У них, следовательно, одинаковый спин. Частицы света - фотоны - передадут мишени вдвое больший вращательный момент, а отдельные частицы, как, например, π-мезоны, вообще не вызовут вращения. Их спин равен нулю.
Количественное значение спина очень точно известно: он равен либо 0, либо 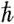 /2, либо
/2, либо 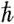 , где
, где  - знаменитая постоянная Планка - квант действия, с которой мы еще будем неоднократно встречаться в дальнейшем. У электрона спин равен
- знаменитая постоянная Планка - квант действия, с которой мы еще будем неоднократно встречаться в дальнейшем. У электрона спин равен  /2. Постоянная Планка настолько мала (число с 27 нулями после запятой), что мишень-копейка будет совершать один оборот в секунду лишь в том случае, если мы будем продолжать ее обстрел 10 000 000 000 000 000 лет, делая по тысяче "выстрелов" в секунду. Может показаться, что вряд ли имеет смысл говорить о такой малой величине, однако не следует торопиться. Здесь ситуация примерно такая же, как если бы мы пытались вызвать вращение Луны, стреляя в нее из нарезного ружья. О "малом" или "большом" спине говорить не слишком разумно: в микромире действуют непривычные для нас масштабы. Важно, что спин существен во многих случаях, в частности при соединении атомов в молекулу.
/2. Постоянная Планка настолько мала (число с 27 нулями после запятой), что мишень-копейка будет совершать один оборот в секунду лишь в том случае, если мы будем продолжать ее обстрел 10 000 000 000 000 000 лет, делая по тысяче "выстрелов" в секунду. Может показаться, что вряд ли имеет смысл говорить о такой малой величине, однако не следует торопиться. Здесь ситуация примерно такая же, как если бы мы пытались вызвать вращение Луны, стреляя в нее из нарезного ружья. О "малом" или "большом" спине говорить не слишком разумно: в микромире действуют непривычные для нас масштабы. Важно, что спин существен во многих случаях, в частности при соединении атомов в молекулу.
Момент количества движения
Электрон, как показывает опыт, может быть закручен только двумя способами: вращение электрона образует либо правый, либо левый винт с направлением его движения. Соответственно может закручиваться и мишень. Говоря другими словами, возможны только две ориентации спина по отношению к любому направлению. Поэтому, если спин одного электрона фиксирован, то спин другого либо параллелен ему, либо антипараллелен.
Что определяет валентность атомов?
Взаимная ориентация спинов оказывается решающим фактором при образовании молекулы водорода. Химическая связь возникает только в том случае, когда коллективизируемые электроны имеют противоположно направленные спины. При столкновении атомов водорода с параллельными спинами электроны также коллективизируются на некоторое время, но стабильных состояний не возникает. Коллективизация в этом случае приводит к появлению сил отталкивания независимо от расстояний между ядрами.
Дело в том, что взаимная ориентация спинов определяет, согласно квантовой механике, характер движения электронов. При антипараллельных спинах электроны проводят сравнительно большое время между ядрами, так что средняя плотность отрицательного заряда оказывается достаточной для компенсации отталкивания ядер. При параллельных спинах эта плотность мала, и происходит отталкивание.

Движение электронов
Электроны с одинаково ориентированными спинами не могут разом втиснуться в промежуток между ядрами, как если бы это были два головастика, пытающихся одновременно, голова к голове, пролезть в узкую щель. Межъядерное пространство доступно для электронов с противоположно направленными спинами, равно как узкая щель - "антипараллельным" головастикам. Но, конечно, кроме одинакового конечного результата здесь нет абсолютно ничего общего. Электрон не головастик и никакие сравнения, никакие ссылки на известные факты классической физики не помогут понять (если оставаться на позициях классики), почему ориентация спинов так существенно влияет на движение электронов: весь эффект чисто квантовый.
Итак, связывающие состояния образует пара электронов, имеющих антипараллельные спины.
Теперь все необходимое для объяснения насыщения и валентности налицо. Начнем с простого. Почему молекула водорода Н2 не может присоединить к себе еще один атом? Почему бы, например, сразу трем электронам не связать все три ядра?
Это запрещено принципом Паули. Коллективизированные электроны находятся в одном и том же квантовом состоянии и поэтому обязаны отличаться ориентацией спинов. Но возможны лишь две ориентации! Поэтому двум электронам с антипараллельными спинами разрешается осуществлять связь, но третий здесь оказывается абсолютно лишним.
После того как молекула водорода образована, она всегда будет отталкивать водородные атомы. Этим и объясняется насыщение.
Вот еще на что здесь нужно обратить внимание. Каждый из водородных атомов, сливающихся в молекулу, имеет по одному электрону с произвольно ориентированным спином. Молекула водорода имеет пару электронов с антипараллельными спинами и не присоединяет к себе новых атомов.
Этот факт имеет совершенно общее значение. Электроны, образующие пары с антипараллельными спинами, в каждом из атомов не принимают участия в химической связи. Эту связь могут осуществлять лишь электроны со свободными спинами.
Во внутренних целиком заполненных оболочках электроны всегда образуют пары и не участвуют в химической связи. Такой же характер имеют внешние оболочки благородных газов, которые по этой причине в невозбужденном состоянии совершенно не активны химически. Лишь в том случае, если внешняя оболочка атома не заполнена целиком, ее электроны могут создавать химическую связь.
Но не все электроны! Число электронов, обладающих "свободными" спинами, а следовательно и валентность атома, равно либо числу внешних электронов, не входящих в замкнутые оболочки, либо же числу электронов, недостающих до завершения оболочки, в зависимости от того, какое из этих чисел меньше.
Таким образом, несмотря на ничтожную в макроскопических масштабах величину, спин электрона определяет всю "химию" атомов. Протекая в больших масштабах, химические реакции, начиная от простого горения и кончая сложнейшими превращениями внутри живого организма, вызывают изменения в мире, преобразующие весь его облик.
Газы, жидкости и твердые тела
Если в самых общих чертах попробовать представить себе строение газов, жидкостей и твердых тел, то можно нарисовать следующую картину. Молекулы (или атомы) газа стремительно, как бегуны-спринтеры, проносятся в пространстве, заполненном газом. Расстояния между ними значительно превышают их собственные размеры. Непрерывно сталкиваясь друг с другом на лету, они дикими зигзагами бросаются из стороны в сторону.
Молекула жидкости ведет себя иначе. Зажатая, как в клетке, между другими молекулами, она совершает бег на месте (колеблется около положения равновесия). Лишь время от времени она совершает прыжок, прорываясь сквозь "прутья клетки", но тут же попадает в новую клетку, образованную новыми соседями. Время оседлой жизни продолжается около десятимиллионной доли секунды.
Атомы твердых тел не в силах разорвать "путы", связывающие их с ближайшими соседями, и обречены совершать только бег на месте. Правда, и они могут иногда покидать положения равновесия, но происходит это редко.
Нельзя обойти молчанием еще одно важное различие между жидкими и твердыми телами. Жидкость, грубо говоря, - это беспорядочная, тесно сжатая толпа индивидуумов, беспокойно толкущихся на месте. Твердое же тело, как правило, - это стройная когорта, индивидуумы которой хотя и не стоят по стойке смирно вследствие теплового движения, но выдерживают между собой определенные интервалы. Если соединить центры положений равновесия атомов или молекул, то получится правильная решетка (пространственная, конечно, а не плоскостная), которая называется кристаллической. Большинство твердых тел имеет кристаллическую структуру. Лишь у аморфных тел, как, например, у стекла, в расположении молекул нет никакого порядка. Их по этой причине часто даже не хотят относить в разряд твердых тел, рассматривая как очень вязкие, почти целиком лишенные текучести жидкости.
Упругие свойства жидкостей и газов
Теперь вы располагаете необходимыми сведениями, чтобы понять происхождение упругих сил в жидкостях и газах. При желании с этим делом вы можете справиться сами. Попробуйте и, если не поленитесь, придумаете то, о чем можно прочесть ниже. Читать же будет скучновато, так что можно продолжать чтение прямо с рассказа о поверхностном натяжении, где дело обстоит много сложнее.
В газах и жидкостях (кроме жидких металлов) из сил притяжения действуют только силы Ван-дер-Ваальса, а в твердых телах еще и обменные силы.
Силы Ван-дер-Ваальса удерживают молекулы жидкости друг возле друга на близких расстояниях порядка размеров самих молекул. Если попытаться жидкость сжать, то молекулы ее начнут сближаться друг с другом и между ними будут быстро нарастать силы отталкивания. Причем молекулы расположены столь тесно, что уже при незначительном сближении силы отталкивания достигают большой величины.
Не правда ли, понять это ничуть не сложнее, чем понять, почему так трудно втиснуться в переполненный автобус.
Не намного труднее объяснить, отчего жидкость текуча, не способна сохранять свою форму. Под влиянием внешней силы (обычно это притяжение к Земле) перескоки молекул жидкости, о которых шла речь, происходят в направлении действия силы, и жидкость в результате течет. Надо только, чтобы время действия силы было много больше времени оседлой жизни молекул. В противном случае сила вызовет лишь упругую деформацию сдвига и обычная вода будет тверда как сталь.
При нагревании энергия теплового движения молекул растет, перескоки молекул учащаются. В конце концов силы Ван-дер-Ваальса оказываются не в состоянии удержать рвущиеся во все стороны молекулы, и жидкость перестает существовать. Образуется газ.
Молекулы газа разлетаются во все стороны, и молекулярное притяжение уже не властно над ними. Вещество перестает сохранять не только форму, но и объем. Как бы мы ни расширяли сосуд, содержащий газ, он заполнит его целиком без каких-либо усилий с нашей стороны.
Барабанная дробь бесчисленных ударов газовых молекул о стенки сосуда создает давление.
Поверхностное натяжение
Такие силы, как тяготение, упругость и трение, бросаются в глаза; мы ощущаем их непосредственно каждый день. Но в окружающем нас мире повседневных явлений действует еще одна сила, на которую мы обычно не обращаем никакого внимания. Сила эта сравнительно невелика, ее действия никогда не вызывают мощных эффектов. Она даже в последнее время не включалась в программы приемных экзаменов для поступающих в вузы. Тем не менее мы не можем налить воды в стакан, вообще ничего не можем проделать с какой-либо жидкостью без того, чтобы не привести в действие силы, о которых у нас сейчас пойдет речь. Это силы поверхностного натяжения.
К вызываемым поверхностным натяжением эффектам мы настолько привыкли, что не замечаем их, если не развлекаемся пусканием мыльных пузырей. Однако в природе и нашей жизни они играют немалую роль. Без них мы не могли бы писать чернилами. Обычная ручка не зачерпнула бы чернил из чернильницы, а автоматическая сразу же поставила бы большую кляксу, опорожнив весь свой резервуар. Нельзя было бы намылить руки: пена не образовывалась бы. Слабый дождик промочил бы нас насквозь, а радугу нельзя было бы видеть ни при какой погоде. Нарушился бы водный режим почвы, что оказалось бы гибельным для растений. Пострадали бы важные функции нашего организма.

Пленка мыльного пузыря - растянутая элестичная пленка
Проще всего уловить характер сил поверхностного натяжения, наблюдая образование капли у плохо закрытого или неисправного крана. Всмотритесь внимательно, как постепенно растет капля, образуется сужение - шейка, и капля отрывается. Не нужно много фантазии, чтобы представить себе, что вода как бы заключена в эластичный мешочек, и этот мешочек разрывается, когда вес превысит его прочность. В действительности, конечно, ничего, кроме воды, в капле нет, но сам поверхностный слой воды ведет себя как растянутая эластичная пленка.
Такое же впечатление производит пленка мыльного пузыря. Она походит на тонкую растянутую резину детского шарика. Если вынуть соломинку из рта, то пузырь вытолкнет воздух и сожмется.
Осторожно положите иглу на поверхность воды. Поверхностная пленка прогнется и не даст игле утонуть. По этой же причине легкие водомерки могут быстро скользить по поверхности воды, как конькобежцы по льду.
Прогиб пленки не позволит выливаться воде, осторожно налитой в достаточно частое решето. Так что можно "носить воду в решете". Это показывает, как трудно порой, даже при желании, сказать настоящую бессмыслицу. Ткань - это то же решето, образованное переплетением нитей. Поверхностное натяжение сильно затрудняет просачивание воды сквозь нее, и потому она не промокает насквозь мгновенно.
В своем стремлении сократиться поверхностная пленка придавала бы жидкости сферическую форму, если бы не тяжесть. Чем меньше капелька, тем большую роль играют поверхностные силы по сравнению с объемными (тяготением). Поэтому маленькие капельки росы близки по форме к шару. При свободном падении возникает состояние невесомости, и поэтому дождевые капли почти строго шарообразны*. Из-за преломления солнечных лучей в этих каплях возникает радуга. Не будь капли сферическими, не было бы, как показывает теория, и радуги.
*(Небольшое отступление от сферичности капель вызвано сопротивлением воздуха. Внутри кабины космического корабля пролитая вода собралась бы в правильный парящий шар.)
Проявления сил поверхностного натяжения столь многообразны, что даже перечислить их в нашей книге нет никакой возможности*. Но почему возникают эти силы, мы обязаны хотя бы кратко рассказать.
*(Это сделано в прекарасной книге Ч. Бойса "Мыльные пузыри", которая, правда, является сейчас библиографической редкостью.)
Если большая группа индивидуумов наделена свойством притягивать друг друга или индивидуумы по своей воле устремляются друг к другу, то результат будет один: они соберутся в ком, подобный пчелиному рою. Каждый индивидуум "стремится" внутрь этого кома, в результате чего поверхность кома сокращается, приближаясь к сфере. Перед вами модель возникновения поверхностного натяжения.
Молекулы воды (или другой жидкости), притягиваемые друг к другу силами Ван-дер-Ваальса,- это и есть собрание индивидуумов, стремящихся сблизиться. Каждая молекула на поверхности притягивается своими собратьями и потому имеет тенденцию к погружению вглубь как в жидких, так и в твердых телах. Но жидкость, в отличие от твердых тел, текуча из-за перескоков молекул из одного "оседлого" положения в другое. Это позволяет жидкости принимать форму, при которой число молекул на поверхности было бы минимальным, а минимальную поверхность при данном объеме имеет шар. Поверхность жидкости сокращается, и мы воспринимаем это как поверхностное натяжение.
Здесь обнаруживается, что происхождение поверхностных сил совсем иное, чем упругих сил растянутой резиновой пленки. И это действительно так. При сокращении резины упругая сила ослабевает, а силы поверхностного натяжения никак не меняются по мере сокращения поверхности плёнки, так как среднее расстояние между молекулами не меняется.
Таким образом, возникновение поверхностных сил нельзя объяснить столь просто и наглядно, как сил упругости, где все связано с изменением расстояний между молекулами. Здесь все сложнее, ибо силы поверхностного натяжения проявляются при сложной перестройке формы всей жидкости без изменения ее объема.
Четыре типа кристаллов
Алмаз и парафиновая свеча... Первый - символ твердости; парафин, подобно воску, мягок и податлив. Сразу можно подумать, что полярности свойств соответствует полярность способов сочленения в единое целое тех отдельных элементов, из которых состоят эти вещества.
Подумав так, вы не ошибетесь. Парафин состоит из отдельных молекул, связанных друг с другом силами Ван-дер-Ваальса. Кристалл алмаза можно рассматривать как одну гигантскую молекулу. Силы молекулярного притяжения значительно слабее химических сил и соответственно парафин не идет ни в какое сравнение по твердости с алмазом.
Кристаллы, состоящие из обособленных молекул, называются молекулярными*. Алмаз - валентный кристалл.
*(К молекулярным кристаллам относятся кристаллы, состоящие из гомеополярных молекул: водорода, азота и др. Сухой лед (твердая углекислота) и многие органические вещества являются также молекулярными кристаллами.)
Такое название дано ему неспроста. Число ближайших соседей каждого атома углерода в алмазе равно его валентности, т. е. четырем. Любые два соседа налаживают между собой парноэлектронную связь, выделяя для этого по одному электрону. Но не надо думать, что коллективизированная пара принадлежит лишь двум атомам. От атома к соседям ведут четыре тропинки (связи), и данный валентный электрон может двигаться по любой из них. Дойдя до соседнего атома, он может перейти к следующему и блуждать по тропинкам - связям вдоль всего кристалла. На плоской схеме кристаллическую решетку алмаза можно изобразить в виде плотно прижатых друг к другу кружков, а парноэлектронные валентные связи - в виде штрихов в точках касания.
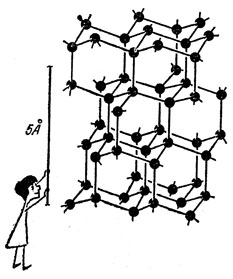
Кристаллы
Единственное непреложное правило, которое должны выполнять электроны, диктуется принципом Паули: по одной "тропинке" не могут двигаться одновременно более двух электронов. Коллективизированные валентные электроны принадлежат всему кристаллу в целом, и поэтому кристалл - это в сущности колоссальная молекула.
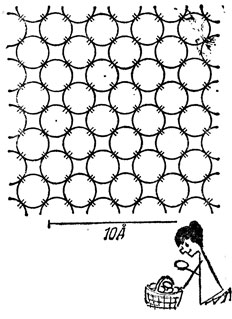
Кристаллическая решетка алмаза
Парноэлектронные связи алмаза очень прочны и не рвутся с увеличением интенсивности тепловых колебаний атомов, т. е. с ростом температуры. Поэтому алмаз не проводит электрического тока. Участвующие в связи атомов валентные электроны прочно привязаны к кристаллической решетке, и внешнее электрическое поле не оказывает заметного влияния на их движение. Кристаллы кремния и германия подобны кристаллу алмаза, но у них парноэлектронные связи не столь прочны. Небольшое нагревание вызывает разрыв отдельных связей. Электроны покидают проторенные тропы и обретают свободу. Во внешнем электрическом поле они перемещаются между узлами решетки, образуя электрический ток. Подобного рода вещества называются полупроводниками.
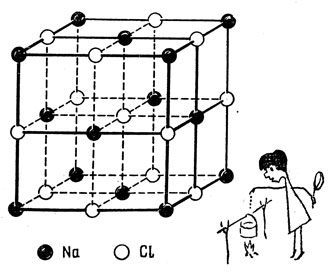
Кристаллы кремния и германия
Коллективизация валентных электронов связывает также атомы так называемых ионных кристаллов: поваренной соли (NaCl), бромистого серебра (AgBr) и др. У молекулы NaCl, как вы помните, коллективизация в сущности сводится к экспроприации хлором одного электрона натрия. То же самое происходит в кристалле поваренной соли. Все валентные электроны фактически движутся по хлорным узлам решетки и кристалл, грубо говоря, состоит из ионов противоположных знаков. Связь в этом случае обеспечивается электростатическими силами притяжения.
Четвертый тип кристаллов - это металлы и сплавы. При образовании куска металла из отдельных атомов валентные электроны полностью утрачивают связь с атомами и становятся "собственностью" всего куска в целом. Положительные ионы "плавают" в отрицательной "жидкости", образованной коллективизированными электронами. Эта "жидкость" заполняет все промежутки между ионами и стягивает их кулоновскими силами. Связь имеет, таким образом, химическую природу, как и у валентных кристаллов*.
*(Природа связи в жидких металлах та же, что и в твердых.)
Но отличие от валентных кристаллов велико. В случае валентных кристаллов коллективизированные электроны циркулируют по строго определенным путям между соседними атомами. В металле электроны оказываются свободными и могут перемещаться по всему куску в любых направлениях. Это проявляется ясно и отчетливо. Металлы и сплавы хорошо проводят электрический ток, в то время как валентные кристаллы в большинстве своем являются изоляторами.
Очень слабая связь валентных электронов металла с атомами, - вот причина той относительной свободы, которую имеют электроны внутри металлов. У валентных кристаллов эта связь значительно прочнее.
Таким образом, только в молекулярных кристаллах связь осуществляется силами Ван-дер-Ваальса. В остальных твердых телах в той или иной форме происходит коллективизация электронов. В аморфных телах, правда, часто происходит наложение связей различной природы. В стеклах одновременно имеет место валентное и ионное взаимодействие; в сложных органических соединениях - одновременно валентное и молекулярное.
Конец цепочки вопросов
После всего сказанного о силах между атомами и молекулами и о строении твердых тел уже совсем просто ответить на вопрос о том, почему при прогибе стола возникают силы упругости. (Менее просто построить количественную теорию, но мы это и не собираемся делать.)
Будет ли стол деревянным, пластмассовым или металлическим - во всех случаях при сжатии атомы сближаются друг с другом и начинают из-за этого отталкиваться. Возникает сила упругости. Растяжению будут препятствовать силы сцепления между атомами и молекулами.
Положенная на стол книга слегка сжимает верхнюю часть доски и растягивает нижнюю. Это продолжается до тех пор, пока расстояния между атомами не изменятся настолько, что упругая сила уравновесит книгу. Если книгу снять, то межатомные расстояния восстановятся, и поверхность стола примет прежнюю форму.
Здесь все просто. Если вы поняли главное - природу электрических сил между нейтральными системами, - то тогда с полным правом можете утверждать, что происхождение сил упругости перестало быть для вас загадкой.
Сухое трение
Итак, мы знаем, почему книга не проваливается сквозь стол. Но что мешает ей соскользнуть, если стол немного наклонен? Конечно, трение!
На первый взгляд объяснить происхождение силы трения очень просто. Ведь поверхность стола и обложка книги шероховаты. Это чувствуется на ощупь, а под микроскопом видно, что поверхность твердого тела более всего напоминает горную страну. Бесчисленные выступы цепляются друг за друга, немного деформируются и не дают книге скользить. Таким образом, сила трения покоя вызвана теми же силами взаимодействия молекул, что и обычная упругость.
Вы увеличили наклон стола, и книга начала скользить. Очевидно, при этом начинается "скалывание" бугорков, разрыв молекулярных связей, не способных выдержать возросшую нагрузку. Сила трения по-прежнему действует, но это уже будет сила трения скольжения. Обнаружить "скалывание" бугорков не представляет труда: результатом такого "скалывания" является износ трущихся деталей.
Казалось бы, чем тщательнее отполированы поверхности, тем меньше должна быть сила трения. До известной степени это так. Шлифовка снижает, например, силу трения между двумя стальными брусками. Но не беспредельно! Сила трения внезапно начинает расти при дальнейшем увеличении гладкости поверхности. Это неожиданно, но все же объяснимо.
Сила трения
По мере сглаживания поверхностей они все теснее и теснее прилегают друг к другу. Однако до тех пор, пока высота неровностей превышает несколько молекулярных радиусов, силы взаимодействия между молекулами соседних поверхностей отсутствуют. Ведь это очень короткодействующие силы. Лишь при достижении некоего совершенства шлифовки поверхности сблизятся настолько, что силы сцепления молекул включатся в игру. Они начнут препятствовать смещению брусков друг относительно друга, что и обеспечивает силу трения покоя. При скольжении гладких брусков молекулярные связи между их поверхностями рвутся подобно тому, как у шероховатых поверхностей разрушаются связи внутри самих бугорков. Разрыв молекулярных связей - вот то главное, чем отличаются силы трения от сил упругости, при возникновении которых таких разрывов не происходит. Из-за этого силы трения зависят от скорости.
Часто в популярных книгах и научно-фантастических рассказах рисуют картину мира без трения. Так можно очень наглядно показать как пользу, так и вред трения. Но не надо забывать, что в основе трения лежат электрические силы взаимодействия молекул. Уничтожение трения фактически означало бы уничтожение электрических сил и, следовательно, неизбежный полный распад вещества.
Трение в жидкостях и газах
При движении двух соседних слоев жидкости друг относительно друга между ними имеется идеальный контакт, неосуществимый при соприкосновении твердых поверхностей, как бы тщательно они ни были отшлифованы. Молекулы более быстрого слоя увлекают за собой молекулы медленного слоя, так как между ними действует молекулярное притяжение, и в свою очередь тормозятся ими. В этом причина вязкости или внутреннего трения в жидкостях.
Из-за текучести жидкости здесь уже не происходит разрыва всех молекулярных связей, как при скольжении твердых поверхностей. Часть молекул "перескакивает" в направлении действия молекулярных сил. Величина трения обратно пропорциональна текучести жидкости и значительно уступает по величине сухому трению, если только относительная скорость слоев жидкости не очень велика*.
*(Надо заметить, что физические процессы как при сухом, так и при жидком трении крайне сложны, и удовлетворительной количественной теории этих явлений не существует до сих пор.)
В газах среднее расстояние между молекулами столь велико, что молекулярное притяжение не может вызвать трения между слоями газа, движущимися друг относительно друга. Если бы молекулы не вылетали за пределы этих слоев, то не было бы трения. Но тепловое движение выбрасывает молекулы за границы слоев. Попадая из быстрого слоя в медленный, молекулы при столкновениях ускоряют этот слой, а молекулы медленного слоя, проникая в быстрый, тормозят его. Появление ускорений означает появление сил. Однако в газах силы трения в сотни раз меньше, чем в жидкостях.
Силы наших мышц
Гравитация непрерывно прижимает нас к Земле, силы упругости поддерживают на ее поверхности. Трение позволяет нам свободно перемещаться. Помогает жить поверхностное натяжение. Все это - силы неживой природы. Большинством из них мы можем управлять. Но можем лишь потому, что к нашим услугам силы, беспрекословно подчиненные велениям разума без всяких механических посредников. Это силы наших мышц.
Мышца - один из самых замечательных "механизмов", созданных природой. Прежде всего это очень экономичная машина, продуктивно использующая около 40% той химической энергии, которую она потребляет. Самая лучшая паровая машина использует не более 10%.
Сила, развиваемая мышцей, заслуживает всяческого уважения. Каждый может встать на цыпочки на одной ноге даже с грузом. Значит, икроножная мышца способна поднять около 100 килограммов. Если же учесть, что стопа представляет собой рычаг и мышца прикреплена к короткому плечу этого рычага, то мы получим еще более солидную цифру: почти тонну. И все это при условии, что человек не может по своей воле заставить ее дать максимальное сокращение. Если регуляция со стороны нервной системы будет нарушена и мышца разовьет свою полную силу, то она способна оторвать кусочек кости, к которой прикреплена.
А поразительная работоспособность мышцы! Сердечная мышца совершает работу день и ночь, непрерывно, без всякого ремонта на протяжении многих десятков лет. На это не способна пока еще ни одна машина, созданная человеком.
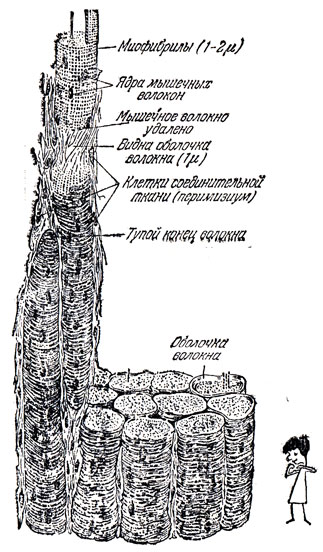
Деятельность мышцы
В основе всей деятельности мышцы лежат сложные химические превращения внутри клеток. Мы не будем говорить обо всех имеющихся здесь проблемах, которые, кстати сказать, остаются в основном нерешенными и до сего времени, даже несмотря на значительные успехи: в последние годы четверо ученых были удостоены Нобелевских премий за работы по выяснению химии мышц. Мы расскажем лишь об одном: как возникает мышечная сила? Что заставляет мышцу сокращаться?
Разрезая бифштекс, вы видите, что мышца имеет волокнистое строение. Под микроскопом хорошо просматриваются тысячи мышечных волокон - длинных цилиндров, уложенных правильными рядами. Каждое волокно - это не одна клетка, а их множество с коллективизированной цитоплазмой и обособленными ядрами. Волокна представляют собой удлиненные палочки - мицелы, построенные из пучков белковых молекул - основного строительного материала живых тканей.
Белковая молекула - это длинная цепь чередующихся друг с другом атомов углерода и азота. После двух атомов углерода следует атом азота и т. д. К первому углеродному атому каждой тройки присоединена более или менее сложная группа атомов. Вся молекула, по выражению американского физиолога Джерарда, напоминает виноградную лозу с отходящими от нее листьями и усиками*. То, о чем мы будем говорить дальше, всего лишь основная идея, объясняющая природу мышечного сокращения. Детали механизма этого процесса (сейчас принят так называемый "скользящий" механизм) очень сложны, и обсуждение его завело бы нас слишком далеко. Тем более, что многое здесь остается дискуссионным или попросту не ясным.
*(Механизм сокращения мышц мы излагаем, пользуясь книгой Джерарда "Функции человеческого тела".)
Белковая молекула погружена в жидкую среду (на 70% мышца состоит из воды), химический состав которой определяет, будут ли боковые группы атомов сцепляться друг с другом, образуя временные связи, или останутся свободными. В результате сцепления боковых групп "спинной хребет" молекулы изгибается.
Если таких соединений будет много, то белковая цепь сильно изогнется и укоротится, подобно тому как укорачивается виноградная лоза при сцеплении усиков и листьев. Это, в принципе, и есть механизм, обеспечивающий сокращение мышцы.
Связи между ответвлениями от ствола белковой молекулы имеют химическую природу. Поэтому и сама мышечная сила в основе своей является химической*.
*(Химическая, а следовательно, электрическая, природа мышечных сил является основой и других гипотетических механизмов сокращения.)
Соединение боковых групп атомов наступает при увеличении щелочности раствора, окружающего мышечное волокно. Добавление же некоторого количества кислоты ведет к расслаблению мышцы.
Но каким же образом из нашего желания перевернуть страницу книги в конце концов возникает изменение химического состава среды в большой группе мышц? На этот вопрос вы не найдете ответа в нашей книге. Не найдете пока и ни в какой другой. Сложная цепь протекающих здесь процессов далеко еще не прослежена во всех своих звеньях.
|
ПОИСК:
|