
Термодинамическая шкала температур
В развитии физики есть моменты, когда новая идея изменяет весь дальнейший ход истории. Об этих моментах говорят как о великих открытиях. У всякого открытия бывают предшественники; но только тогда, когда физические идеи находят точное математическое оформление, они начинают жить своей жизнью, не зависящей часто от своего создателя.
В первой половине XIX века появились три великие идеи, которые определили и сделали неизбежным рождение новой физики на рубеже следующего века. Это идея поля Фарадея - Максвелла, идея превращения и сохранения энергии Майера и идея термодинамики Карно. С разной степенью законченности появились эти идеи. Блеск математического аппарата Максвелла обусловил создание завершенной электродинамики. Почти без формул завоевала мир идея Майера. Карно доказал только одну теорему, из которой следовала простая формула 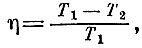 но за этой формулой скрывалась целая наука.
но за этой формулой скрывалась целая наука.
Подобно тому, как создатель волновой теории света Френель, пользуясь моделью эфира для вывода формул оптики, получил законы, не зависящие от модели, так и Карно сумел извлечь из модели теплорода столь общие результаты, что их не могло поколебать все дальнейшее развитие физики. Термодинамика, возникшая из небольшой статьи Карно, и сейчас представляется необычайным созданием разума человека. После Карно - и это было одним из самых важных результатов его идеи - понятие температуры приобрело, наконец, точный смысл.
Когда-то Галилей открыл, что все тела, независимо от их природы, падают с одинаковым ускорением. Ньютон открыл, что сила притяжения тел не зависит от их природы и зависит только от их массы. Открытие Карно имеет столь же общий характер.
Теорема Карно была первым строгим результатом в теории тепла. Все, что было известно о тепле раньше, носило, так сказать, описательный характер. Физики (и инженеры) знали, как описывать разные тепловые процессы, знали, сколько тепла надо затрачивать на нагревание разных тел и сколько тепла выделяется при сгорании топлива. Короче, они умели сравнивать равные количества теплоты и измерять термометром температуру, но не понимали, что означают эти понятия.
Майер и Джоуль открыли связь между теплом и энергией, Карно понял, как происходит превращение тепла в работу. После этого настало время понять, что такое температура. Температура казалась похожей на энергию: добавляем тепло - повышается температура тела; тело совершает работу - его температура падает. Но такая простая связь существует, когда речь идет об одном теле.
Сравнив тепловое поведение двух тел, мы наткнемся на трудность. Легко сравнить, какое из двух тел теплее, а какое холоднее, но нельзя "отнять" у одного тела один градус и нагреть на тот же градус другое тело. Теплоемкость разных тел - количество теплоты, нужное для нагревания тела на один градус,-тоже разная, да еще и изменяется с температурой. Было ясно, что если два тела имеют одинаковую температуру, то отсюда совсем не следует, что в них заключена одинаковая энергия.
Температуру измеряли термометрами - по длине столбика ртути или спирта или по объему газа в запаянном приборе. Оба способа, конечно, не могут считаться безукоризненными.
Ртутные и спиртовые термометры вообще не годятся для точных измерений: они основаны на предположении, что расширение ртути и спирта пропорционально изменению температуры, - предположении, которое, как очевидно, носит приближенный характер. Да и проверка это-го приближения требует определения температуры каким- то другим методом.
В действительности физикам повезло. Измерение температуры газовым термометром оказывается хорошим методом благодаря счастливому свойству газов вести себя при малых плотностях почти одинаково. Из школьного курса физики мы знаем, что газы хорошо описываются одним и тем же уравнением состояния.
Секрет удачи состоит в том, что почти все газы, которые встречаются в природе, переходят в жидкое состояние при очень низких температурах. Во времена Карно даже думали, что такие газы, как кислород, азот, всегда остаются газами (их и называли постоянными газами). Вдали же от точки сжижения газы ведут себя, как идеальные.
Поэтому газовый термометр до сих пор служит основным прибором для самых точных измерений температуры. В реальных условиях такие измерения - дело достаточно сложное, но основной принцип прост и хорошо понятен.
Однако и газовый термометр далек от желанного идеала. Хорошо было физикам в прошлом веке, когда в лабораториях не было ни очень низких, ни очень высоких температур. Сейчас же в лабораториях достигаются температуры ниже -273 °С, а в термоядерных установках - десятки миллионов градусов.
Ясно, что температура должна быть определена, по крайней мере теоретически, без ссылок на свойства каких- либо конкретных веществ, пусть даже идеальных газов. Но прежде чем перейти к новым идеям, остановимся немного на вопросе о том, откуда взялась единица температуры.
Сначала она, как мы знаем, возникла случайно - поставили число 100 в точке кипения воды. Этот акт имел важные последствия: в уравнении Менделеева - Клапейрона появилась газовая постоянная R=8,3157 джоуль/градус. Такое число возникло только потому, что величина градуса была введена очень давно и все изменения, происходящие с газами, по привычке относили к довольно случайно выбранной шкале температур. Было бы удобнее сейчас изменить определение градуса и "привязать" его к уравнению идеальных газов. Для этого надо просто уменьшить величину градуса в 8,3157 раза и считать, что температура в такой "идеально-газовой" шкале
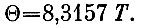
Тогда уравнение Менделеева - Клапейрона имело бы вид
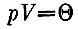
и справа не было бы никакой постоянной. Но так пока не принято делать и постоянную R в науке сохраняют, а величину градуса продолжают определять по старому термометру Цельсия.
Постоянная R имеет размерность джоуль/градус. Выбирая другую единицу для градуса, можно, как мы видели, сделать R=1. Это значит, что градусы можно измерять в джоулях - единицах энергии. Градусы, калории и джоули в конце концов оказываются только разными единицами для измерения одной и той же величины - энергии. Связь калории с джоулем определяет "механический эквивалент тепла"; связь градуса и джоуля - постоянную Больцмана.
Их существование - напоминание о том, что учение о теплоте и механика были разными науками.
|
ПОИСК:
|