
Глава вторая. Молекулярно-кинетическая теория идеального газа
§ 6. Понятие об идеальном газе и уравнение состояния
Как для упрощения изучения движения тела мы пользовались абстрактным понятием материальная точка, а при изучении движения жидкости - идеальная жидкость, так и при изучении газов мы будем пользоваться понятием идеальный газ. Воображаемый газ, размерами молекул которого можно пренебречь, считая их материальными точками, между которыми нет сил молекулярного взаимодействия, называется идеальным газом. В природе идеального газа нет, это только воображаемый газ. В несжатых реальных газах силы взаимодействия между молекулами очень малы Пренебрегая ими, считают, что такие газы близки к идеальным. Наиболее близкими к идеальному газу являются гелий и водород.
При нормальных условиях только 0,04% объема, занимаемого газам, приходится на долю самих молекул, а 99,96% пространства составляет свободный от молекул объем. При этом промежутки между молекулами в среднем в 10 раз больше размера самих молекул. В случае применения законов идеального газа к сильно сжатым реальным газам в эти законы вводят поправки на объем молекул и межмолекулярные силы. Соударение молекул со стенками сосуда так же, как и между собой, является вполне упругим. От соударения до соударения молекулы движутся по инерции равномерно и прямолинейно. Суть соударения молекул, атомов заключается в сближении до деформации внешних электронных оболочек, что заставляет разлетаться молекулы и атомы в разные стороны (рис. 7). Расстояние, которое пролетает молекула между двумя последовательными соударениями, называется длиной свободного пробега. При нормальных условиях каждая молекула газа совершает приблизительно 109 соударений в секунду, а средняя длина их свободного пробега составляет около 0,0001 мм.
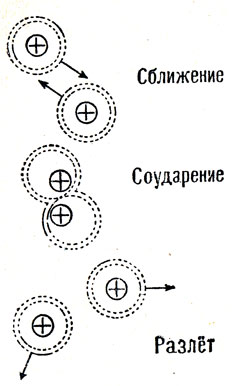
Рис. 7. Схема соударения двух атомов
Совокупность тел, входящих в рассматриваемое явление, называется системой. Примером системы является жидкость и ее пар. Возможна система и из одного тела, например газ, жидкость. Всякая система может находиться в. различных состоя них, отличающихся температурой, давлением, объемом и т. д. Величины, характеризующие состояние системы, называются параметрами состояния. Основными параметрами состояния газа являются давление" температура, объем и масса.
Если мяч, находившийся на морозе, внесем в комнату, то тем самым изменим температуру воздуха в нем. При этом объем мяча увеличится и мяч станет более упругим от повышения давления воздуха в нем. Значит параметры состояния зависят друг от друга, т. е. изменение одного из них вызывает изменения остальных. Вследствие этого состояние системы становится иным. Уравнение, определяющее функциональную связь между параметрами состояния системы, называется уравнением состояния. Любое изменение в системе, связанное с изменением хотя бы одного из ее параметров состояния, называется процессом.
Молекулы газа, двигаясь хаотично, сталкиваются друг с другом, вследствие чего у них различные скорости. При этом имеется определенное число молекул, скорости которых одинаковы, например 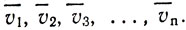 Статистические подсчеты показывают, что в хаотическом движении молекул есть закономерности. Так, среднее число молекул, движущихся в одном направлении, равно среднему числу молекул, движущихся в другом направлении.
Статистические подсчеты показывают, что в хаотическом движении молекул есть закономерности. Так, среднее число молекул, движущихся в одном направлении, равно среднему числу молекул, движущихся в другом направлении.
Газ является системой, которая вследствие множества и хаотичности движения молекул характеризуется статистическими величинами. Например, тепловое движение характеризуется средней квадратичной скоростью движения молекул. Пусть газ в сосуде содержит n молекул, имеющих скорость от v1 до vn. Средней квадратичной скоростью будет являться
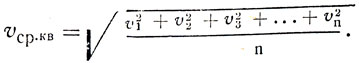
Используя среднюю квадратичную скорость, вычисляют давление газа, его внутреннюю энергию, вводят понятие о температуре. В дальнейшем, говоря о скорости движения молекул, мы будем иметь в виду среднюю квадратичную скорость.
Газы и перегретый пар имеют широкое применение, например в тепловых машинах, в пневматических устройствах, технологических процессах, сельском хозяйстве, медицине. Чтобы более эффективно использовать газы, надо знать физическую природу величин, характеризующих газ, и закономерности связей между параметрами.
|
ПОИСК:
|