
Газовые законы и атомистика
Переворот, совершённый в химии Лавуазье и его современником Бертолле, о котором нам неоднократно приходилось говорить, заключался в изгнании из химии перипатетических "начал" или "элементов" и в перебазировке химии на новом понятии химического элемента. На первый план выдвигалась задача точного химического анализа, разложение сложных соединений на составные части, поиски действительно простых, вещественных элементов. Уже упомянутые нами исследования состава воды были первым крупным шагом в этом направлении. Защитники аристотелевской концепции воды как первоначального элемента, к числу которых принадлежал и неоднократно упоминавшийся нами Риттер, пытались в электрохими-ческих явлениях найти подтверждение своих воззрений. Сложные продукты электролиза воды они объясняли возникновением из воды кислот и щелочей под действием электричества. Это мнение было, как мы говорили выше, разбито Дэви. Дэви удалось доказать элементную природу хлора*, который считали окислом металла. Не следует удивляться тому, что, казалось бы, такие простые химические вопросы, как сложность воды или элементарность хлора, могли вызывать сомнения. Методы качественного и количественного анализа только вырабатывались, и более удивительно, что уже в ту пору успехи в этом отношении оказались настолько значительными, что дали материал для построения химической атомистики.
* (Это же открытие было сделано независимо от Дэви Гей-Люссаком.)
Выдающиеся химики XVIII и начала XIX в., как, например, Бертолле, считали, что состав сложных веществ может изменяться непрерывно в любых количественных отношениях входящих в них элементов. Авторитет Бертолле, знаменитого французского химика, сподвижника Монжа, активного участника создания химической оборонной промышленности революционной Франции, был очень велик. Бертолле был основателем так называемого Аркельского общества, просуществовавшего десять лет (1807-1817), в числе членов которого были Лаплас,Гей-Люссак, Гумббльдт, автором классических "Исследований о законах химического сродства" и "Химической статики".
Тем не менее соотечественник Бертолле Пруст (Proust, 1755- 1826) в 1801 г., в год выхода "Исследований" Бертолле, высказывает идею о постоянстве состава. Анализируя соединения олова с кислородом, он находит, что процентное содержание олова в различных окислах меняется скачком, а не непрерывно, как утверждал Бертолле, и тем самым было положено начало знаменитому спору, окончившемуся в 1808 г. победой Пруста. Несколько ранее Рихтер (1762-1807) в "Стехиометрии" провозгласил принцип числа и меры в химии и начал, правда ещё в очень туманной форме, вводить в химию понятие эквивалента.

Дальтон
Но подлинным основателем химической атомистики был сын ткача, школьный учитель математики и физики Джон Дальтон (5 сентября 1767 г. - 27 июля 1844 г.), за свои научные заслуги избранный иностранным членом Парижской академии. От Дальтона открывается новый период не только в истории химии, но и в истории учения о материи вообще, период, который завершается гениальным открытием Менделеева. К своим воззрениям Дальтон приходит, отправляясь от исследований свойств паров и газов, приведших его - вместе с Гей-Люсеаком - к установлению основных законов газового состояния.
Мы уже упоминали, говоря о Ломоносове, о противоречивых результатах измерений теплового расширения воздуха. С развитием пневматической химии число измерений расширения не только воздуха, но и других газов увеличилось, а вместе с тем возросли и противоречия в результатах. Знаменитый французский физик и химик Гей-Люссак (6 декабря 1778 г. - 9 мая 1850 г.) в поисках источников этих расхождений пришёл к мысли о необходимости тщательного просушивания газов.
Измерения Гей-Люссака, выполненные им с воздухом, водородом, азотом и другими газами, дали ему одно и то же значение коэффициента расширения газов, а именно 0,00375, или 1/266,6. Эти опыты, которые,- говорит Гей-Люссак,- "были произведены мною с величайшей тщательностью, ясно показывают, что атмосферный воздух, кислород, водород, азот, пары азотной кислоты, аммиака, соляной, серной и угольной кислот при одинаковом повышении температуры расширяются тоже равномерно... и что все газы вообще, насколько я могу заключить, расширяются от теплоты в одинаковой степени". Гей-Люссак указывает, что за 15 лет до него Шарль пришёл к тому же выводу, но не опубликовал своих результатов. Однако Гей-Люссак не знал, что уже в 1801 г. в "Журнале Никольсона" Дальтон опубликовал результаты своих измерений с воздухом, просушенным серной кислотой, и нашёл α = 0,00373 и что впоследствии он также пришёл к выводу об одинаковой расширяемости как газов, так и паров.

Гей-Люссак
Изучение поведения паров представляло большой практический интерес, и не случайно Уатт, работая над паровой машиной, в течение ряда лет изучал упругость водяных паров как при высоких температурах с папиновым котлом, так и при низких температурах с барометрическими трубками.
Дальтон, исследуя упругость паров при разных температурах, получил таблицы, вошедшие в учебник физики Био и, таким образом признанные наиболее надёжными. Однако Дальтон полагал, что упругость паров различных жидкостей при одной и той же температуре одинакова. С другой стороны, исследуя смеси газов и паров, не взаимодействующих между собой химически, он обнаружил замечательное свойство диффузии газов. Явление диффузии газов было открыто ещё в 1796 г. Вольта для: водорода и воздуха. Дальтон производил опыты с различными газами по следующей схеме: две колбы, герметически закупоренные и сообщающиеся между собой стеклянными трубками, были заполнены различными газами и установлены вертикально одна над другой, причём в нижней колбе был более тяжёлый газ (например О2), в верхней - более лёгкий (например Н2). Через несколько часов в колбах были смеси обоих газов. Отсюда Дальтон делает вывод, что "упругие жидкости (т. е. газы), приведённые в соприкосновение, неизменно перемешиваются между собой... более лёгкая жидкость не может оставаться отделённо над жидкостью более тяжёлой... обе они постоянно стремятся проникнуть друг в друга..." Поэтому, газ расширяется в пространстве, занятом другим газом, так, как если бы другого газа не было, и производит соответствующее парциальное давление так, что общее давление смеси равно сумме парциальных давлений отдельных компонент.
Дальтон не знал работ Бернулли и Ломоносова, и кинетика газов, которая так блестяще подтверждается открытиями, не выдвигалась им. Но его внимание привлекло постоянство и неизменность в поведении таких текучих тел, как газы. Это постоянство было им обнаружено и в газообразных соединениях.
Исследуя химический состав сначала газообразных окислов, а затем углеродно-водородных групп, Дальтон впервые изучает весовые количества кислорода, приходящиеся на одно и то же весовое количество вещества (например азота) в различных по количественному составу окислах и устанавливает кратность этих количеств. То же самое он заметил на углеводородных соединениях: количества водорода, приходящиеся на одно и то же весовое количество углерода в двух соединениях (С2Н4 и СН4), относятся как 1:2. Так был открыт важнейший закон химии - закон кратных отношений.
Дальтон не ограничился установлением эмпирических закономерностей, а сразу же выдвинул объяснение найденных фактов. Удивительное постоянство химических и физических свойств вещества приводило к мысли о существовании постоянных, неизменных атомов. "Все изменения, которые мы можем производить, заключаются в разделении прежде связанных атомов и в выделении прежде разделённых атомов". Но эта старая мысль атомистов теперь опирается на твёрдые химические факты. Постоянство состава веществ объясняется полной однородностью образующих их частиц, а различие в свойствах различных элементов объясняется химической индивидуальностью их атомов.
При этом Дальтон вводит в химию важную характеристику этой индивидуальности - атомный вес. Закон кратных отношений находит своё объяснение в том, что один атом какого-либо вещества, например олова, соединяется с одним, двумя, тремя и т. д. атомами кислорода.
Простые вещества - химические элементы (в то время ещё не делали различия между элементом и простым веществом) - состоят из простых атомов, сложные - из сложных атомов (молекул). Для обозначения атомов Дальтон ввёл специальные значки, например, атомы водорода Дальтон обозначает значком  , кислорода ○, серы ⊕ и т. д. Приняв атомный вес водорода за единицу, Дальтон приступил к определению атомных весов других веществ. Эта задача, конечно, была весьма неопределённой, так как точные комбинации реагирующих атомов не были известны. В работе 1803 г. Дальтон находит такие значения атомных весов
, кислорода ○, серы ⊕ и т. д. Приняв атомный вес водорода за единицу, Дальтон приступил к определению атомных весов других веществ. Эта задача, конечно, была весьма неопределённой, так как точные комбинации реагирующих атомов не были известны. В работе 1803 г. Дальтон находит такие значения атомных весов
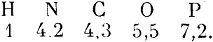
В 1808 г. вышло основоположное произведение Дальтона: "Новая система химической философии", и здесь Дальтон даёт уже новые целочисленные значения
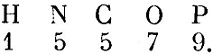
В связи с этим возникла знаменитая гипотеза Проута (1815); все атомы представляют комбинацию атомов водорода и, следовательно, атомные веса должны выражаться целыми числами, если вес атома водорода принять за единицу. Но шведский химик Берцелиус (29 августа 1779 г. - 7 августа 1848 г.), поддержавший атомную теорию Дальтона, понял важность задачи точного определения атомных весов и в 1818 г. опубликовал первую таблицу атомных весов, значение которых точностью до целочисленных факторов, обусловленных указанной выше неопределённостью, очень близко подходят к современным данным
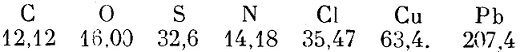
Целочисленность атомных весов не имеет места, и в дальнейшем развитии химии гипотеза Проута была оставлена, однако не без борьбы. Она была воскрешена только в XX в. Отметим, что Берцелиус первый ввёл современные обозначения атомов химических элементов начальными буквами их латинских названий.
Открытия и гипотеза Дальтона встретили поддержку и у Гей-Люссака. Существенную помощь в определении атомных весов сыграл опубликованный в мемуарах Аркельского общества за 1809 г. закон кратных объёмов для химических взаимодействий газов: "Газы, действуя друг на друга, соединяются по, объёмам в простых отношениях, как, например, 1 к 1, 1 к 2 или 2 к 3".
Этот закон может быть истолкован (что и было сделано Берцелиусом, Дальтоном и Гей-Люссаком) допущением гипотезы, что в равных объёмах газов находится при одинаковых условиях равное количество частиц. Гей-Люссак воспользовался своим законом для определения плотности паров, Берцелиус - для определения относительных атомных весов. Но атомная интерпретация закона Гей-Люссака встретила возражения. Первое из них заключалось в открытой неточности Дальтоно - Гей-Люссаковского закона одинакового коэффициента расширения.
Положим, что при определённой температуре t1 и данном давлении два различных газа занимают одинаковые объёмы v1 и v1 и соединяются друг с другом в отношении 1:1, т. е. частица с частицей. Но при другой температуре t2 их объёмы будут различными и, если число частиц не изменилось, то отношение 1:1 уже не будет иметь места.
Био защищает Гей-Люссака от обвинений в теоретическом истолковании его закона: "Предполагаемая простота отношений,- говорит Био,- очевидно, может существовать только в том случае, когда пренебрежём неравенством расширения газов, которое, будучи всегда нечувствительным в обыкновенных химических опытах, ограничивает закон объёмов теоретически, а не практически. Не должно обвинять Гей-Люссака в системах, которые хотели основать на его законе; он никогда не принимал их; гипотезы были противны его строгому уму".
Это типичное выступление ньютонианца против самой мощной и плодотворной научной системы является одним из многих аналогичных выступлений. Атомная теория, как мы увидим далее, будет яростно атаковываться сторонниками идеалистических, реакционных направлений и школ.
Другим очень важным аргументом против атомистической интерпретации Гей-Люссаковского закона были факты, найденные тем же Гей-Люссаком. Положим, что один объём Н соединяется с одним объёмом О. Это означает, что частица Н соединяется с частицей О и они образуют одну частицу хлористого водорода. Если допустить, что в равных объёмах газов содержится одинаковое количество частиц (простых или сложных), то тогда два равных объёма Н и Cl должны дать один объём HCl, но опыт показывает, что получается также два объёма этого вещества.
Это противоречие, как показал в 1811 г. итальянский химик Авогадро (1776-1856), устраняется, если ввести гипотезу, что в равных объёмах газов при одинаковых условиях содержится равное количество молекул, отличая последние от атомов, причём молекулы одного и того же элемента могут состоять из нескольких атомов.
В данном примере гипотеза двух атомности молекул Ни О полностью объясняет реакцию, которая происходит по уравнению Н2 + O2 = 2НCl. Однако Берцелиус, выдвинувший электрическую теорию химического сродства (он считал металлы электроположительными, металлоиды - электроотрицательными), не мог допустить ассоциации однородных атомов в одну молекулу. Вообще, даже сторонникам атомной теории представлялось нежелательным её усложнять, а предположение, что следует различать частицы простого вещества, казалось таким излишним усложнением. Поэтому гипотеза Авогадро не встретила поддержки, так же как и выдвинутое Ампером в 1814 г. предложение различать частицы и атомы вещества. Гипотеза Авогадро была оставлена, и её новое "издание" в 1842 г. в работе Жерара также не имело успеха. Тем не менее атомная теория в химии начала своё победное шествие.
|
ПОИСК:
|