
Атомная теория и химии
Несмотря на успехи, достигнутые молекулярно-атомной теорией в физике, новым "идеям предстояла ещё длительная и напряжённая борьба за признание. Борьба развернулась в первую очередь в химии. И физики (Клаузиус а Максвелл) сыграли значительную роль в укреплении позиций атомистики в химии. Мы знаем, что основные законы химии: закон постоянства состава, закон кратных отношений и закон паев* допускают естественное истолкование с точки зрения атомных представлений, однако на них смотрели, как на эмпирические отношения, и вместо понятия атомный вес предпочитали пользоваться понятием эквивалентный вес. Химические формулы не выражали со всей определённостью весового состава сложных веществ. Идеи Авогадро и Ампера по истолкованию законов реагирующих объёмов Гей-Люссака не получили признания. Борьба за внедрение атомно-молекулярных представлений в химию развернулась снова в 40-х и 50-х годах. Эту борьбу начали Жерар и Клаузиус.
* (Закон паев гласит: если определённое весовое количество тела С соединяется с определённым весом тела А и, с другой стороны, с определённым весом тела В, то, в случае возможности реакций между А и В, весовые количества их будут равны или кратны тем весам, с которыми они реагируют с С.)
Когда Жерар (1816-1856) направлялся в Париж, знаменитый химик Либих предостерегал его: "Прежде всего будьте осторожны со своими теоретическими воззрениями, ибо академия - неумолимый враг теорий; она всегда была им". После того как Либих познакомился с первыми попытками Жерара применить молекулярную теорию в химии, он вновь писал:
"Поверьте моей опытности: для теорий нет более опасной почвы, чем Франция... Академия издавна считает только за собою право устанавливать законы науки и рассматривает как вора и разбойника всякого, кто делает это вместо неё; молодой человек, желающий заставить или заставляющий старых господ преподавать по его законам, не должен более рассчитывать на самый ничтожный успех".
Последняя цитадель ньютонианства, французская академия, действительно продолжала ревностно охранять старые традиции. Английская и немецкая наука уже ушли вперед, а французские учёные, цепляясь за былой престиж, воспитывали подозрение к теоретической мысли. Однако Жерар не послушался советов Либиха и продолжал разработку теоретических основ химии, которые и были изложены им в трактате по органической химии. Анализируя различные случаи углеводородных соединений, Жерар приходит к выводу, что весовые количества веществ, вступающих в химическую реакцию, занимают в газообразном состоянии равные объёмы. Так, например, 2 г водорода (приблизительно), вступая в реакцию с 71 г (приблизительно) хлора, образуют два объёма хлористого водорода. 2 г водорода занимают, по закону Жерара, такой же объём, как 71 г хлора, как 36,5 г газообразного хлористого водорода.

Жерер
С точки зрения молекулярной теории это означает, что в равных объёмах газов при одинаковых условиях содержится равное количество молекул (гипотеза Авогадро). Поэтому, сравнивая плотности газов и паров, можно сравнивать молекулярные веса. Из гипотезы Авогадро - Жерара вытекает ряд следствий. Плотность водяного пара в 9 раз больше плотности водорода, а плотность кислорода - в 16 раз. Опыт показывает, что 18 г водяного пара будут занимать такой же объём, как 2 г водорода. Таким образом, молекулярный вес водорода будет в два раза больше его атомного веса.
Могут быть молекулы простых веществ, составленные из нескольких атомов. Эта мысль, высказанная ещё Авогадро и Ампером, была независимо от Жерара вновь выдвинута со всей определённостью Клаузиусом. "Я допускаю,- писал Клаузиус,- что сила, которая вызывает образование химических соединений и которая, вероятно, заключается в некотором виде полярности атомов, проявляется уже и в простых телах и что в последних тоже несколько атомов соединяются в одну молекулу". Эта гипотеза объясняет объёмные соотношения Гей-Люссака и, как считал Клаузиус, с её помощью можно "все объёмные отношения газов свести к закону, согласно которому отдельные молекулы всех газов по отношению к своему поступательному движению обладают равной живой силой".
И, действительно, в этом случае получается закон Авогадро: в равных объёмах различных газов содержится одинаковое количество молекул.
Закон Жерара позволяет определить молекулярные веса. Для этого надо только определить массы тех веществ, которые вступают в реакцию в газообразном виде равными объёмами. Такие реакции имеют место в большинстве случаев. Конечно, не исключены случаи и реакций неравными объёмами. Но и здесь часто удаётся найти предшествующую реакцию между равными объёмами. Так, например, соединения хлора с болотным газом дают четыре вещества: CH3Cl, СН2Сl2, СНСl3, ССl4. Уравнения соответствующих реакций имеют вид:
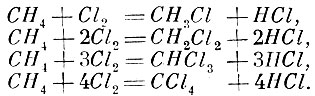
Но первая реакция является предшествующей и выполняется между равными объёмами. Тогда и вторую реакцию можно осуществить, как реакцию между равными объёмами:
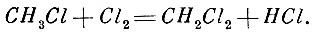
Дальнейшее насыщение хлором сводится к реакции между равными объёмами СН2Сl2 и Сl2 и последняя реакция - реакция между СНСl3 и Сl2. Во всяком случае, осуществив такие реакции, мы сразу заключаем, что массы этих равных объёмов относятся как молекулярные веса.
Поэтому, если М1 - молекулярный вес одного вещества, D1 - его плотность в парообразном состоянии, М2 - молекулярный вес и D2 - плотность другого вещества, то, по закону Жерара,
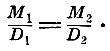
Если принять вес атома водорода за 1, а его молекулярный вес за 2, то
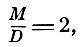
где D - плотность пара по отношению к водороду, т. е. молекулярный вес вещества равен удвоенной плотности его пара, взятой по отношению к водороду. Наименьшее весовое количество вещества, входящее в молекулу, даёт относительный атомный вес.
Так, по Жерару, атомный вес кислорода оказался 16 (а не 8, как думали раньше), углерода 12 (а не 6) и т. д. Понятно, насколько упростились и уточнились химические расчёты. Отступления от соотношения М = 2D, если они превышают точность эксперимента, могут означать либо полимеризацию молекул, либо их диссоциацию в условиях опыта, либо просто наличие примесей.
Менделеев, приведя один из примеров того, как закон Авогадро - Жерара позволил установить наличие примеси в одной жидкости, восклицает: "Так следование за действительным законом природы помогает достигать правдивых выводов". Но тот же Д. И. Менделеев рассказывает, какое отношение встретила теория Жерара у руководящих химиков.
"В 50-х годах одни принимали O = 8, другие O = 16, если Н = 1, Вода для первых была НО, перекись водорода НO2, для вторых, как ныне, вода Н2O, перекись водорода Н2O2 или НО. Смута, сбивчивость господствовали. В 1860 г. химики всего света собрались в Карлсруэ для того, чтобы на конгрессе достичь соглашения, однообразия. Присутствовав на этом конгрессе, я хорошо помню, как велико было разногласие, как с величайшим достоинством охранялось корифеями науки условное соглашение и как тогда последователи Жерара, во главе которых встал итальянский профессор Канницаро, горячо проводили следствия закона Авогадро".
Однако химическая практика заставила принять закон Жерара и его метод определения атомных весов, забыв о неприятных предпосылках закона.
Новые жераровские веса атомов стали входить во всеобщее употребление.
"Таково свойство гипотез,- говорит Менделеев по поводу атомной теории в химии.- Они науке, и особенно её изучению, необходимы. Они дают стройность и простоту, каких без их допущения достичь трудно. Вся история наук это показывает. А потому можно смело сказать: лучше держаться такой гипотезы, которая может оказаться со временем неверною, чем никакой. Гипотезы облегчают и делают правильною научную работу - отыскание истины, как плуг земледельца облегчает выращивание полезных растений".

Менделеев
Поэтому-то передовые деятели науки, в том числе и сам Д. И. Менделеев, поддержали атомную гипотезу и развили её дальше. Химический атом, одинаковый в разнообразных химических превращениях, воспринимается как неизменный индивидуум с резкоочерченными свойствами. Атомный вес, который так много помог в распутывании сложнейших химических реакций, естественно, со времён Дальтона рассматривался как первичная характеристика атома.
Абсолютно непревратимые, абсолютно неизменные атомы, каждый со своим весом, который меняется от атома к атому без всякого закономерного порядка - скачком, такова была ведущая концепция в учении об атомах (см. выдержки из речи Максвелла в "Введении").
Д. И. Менделеев, руководясь гипотезой, что свойства элементов должны зависеть от их атомных весов, и, тем самым, бессознательно применив закон о переходе количества в качество, пришёл к своему великому открытию. В 1869 г. вышли "Основы химии". В начале книги была помещена таблица:
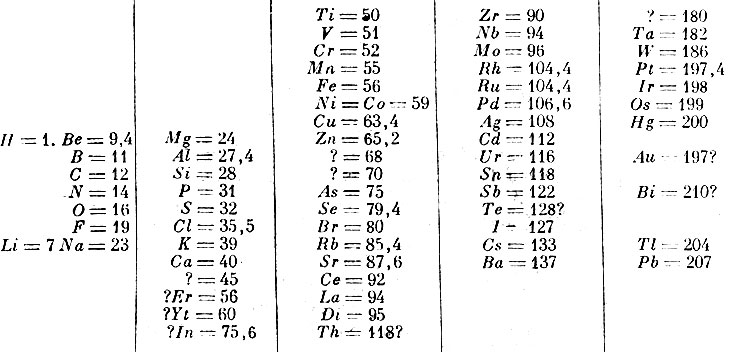
Опыт системы элементов, основанной на их атомном весе и их химическом сродстве
Этим открытием завершалась старая атомистика, атомистика неизменного атома, атомистика, основанная на понятии атомного веса. Наступала пора новой атомистики, с изменчивым превратимым атомом, свойства которого определялись атомным номером в Менделеевской таблице. История этой новой атомистики составляет содержание нового этапа в развитии науки.
|
ПОИСК:
|