
Теплоемкость
В последующих разделах книги нам неоднократно придется пользоваться понятием теплоемкости. Читатель, по-видимому, встречался с ним и раньше, однако это понятие нуждается в некотором пояснении.
Удельная теплоемкость - это количество энергии, которое необходимо для повышения температуры единицы массы вещества на одну единицу. Предположим, что закрытому сосуду с идеальным газом сообщается некоторое количество энергии Q. При достижении равновесия эта энергия распределится среди N молекул, что приведет к повышению внутренней энергии U на величину ΔU, то есть

Как мы уже знаем, внутренняя энергия идеального газа равна кинетической энергии его молекул, следовательно

Но поскольку общая масса M газа пропорциональна числу молекул N, а величина ΔE пропорциональна приращению температуры ΔT, то уравнение (3.9) принимает вид
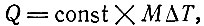
или

Постоянная cv называется удельной теплоемкостью при постоянном объеме. Оговорка относительно постоянства объема необходима, так как при нагревании газа в сосуде, объем которого может изменяться, температура газа изменяется иначе. Например, если газ находится в баллоне, то увеличение давления газа может привести к расширению баллона. Тогда сообщаемая энергия расходуется и на расширение, и на повышение внутренней энергии газа. В этом случае теплоемкость оказывается больше, чем при постоянном объеме.
Уравнение (3.11) позволяет определять теплоемкость любого вещества. При нагревании твердого тела не всегда возможно полностью предотвратить его расширение. Тогда вводят понятие удельной теплоемкости при постоянном давлении. Очевидно, при других ограничениях мы получим иные значения теплоемкости.
|
ПОИСК:
|