
Артефакт или открытие?
Артефакт или открытие...
Когда в колебательном спектре молекулы появляется в характеристической области спектра "лишняя" линия, т. е. интенсивная, но не оправданная принятой структурной формулой соединения деталь спектра, то подавляющее большинство спектрохимиков достаточно уверенно заявляет: это резонанс Ферми. Если в эксперименте кристалл, то мнения могут разделиться. Потому что для кристаллов кроме резонанса Ферми, сводящегося к усилению интенсивности обертона или составного тона при взаимодействии с тоном основным при близости их частот, возможен еще резонанс Давыдова, обусловленный коллективными колебаниями молекул в элементарной ячейке.
Заглянем в монографию Кольрауша, прекрасный обзор по спектрам комбинационного рассеяния, написанный еще в военные годы. Откроем страницу 281, где обсуждаются данные по производным ацетилена, и прочитаем: "Если в общем непонятно, как могут иметь место общие явления в системах № 8-13, различных между собой и отличных от систем № 1-7, то еще менее понятно многократное расщепление в спектрах № 8-10".

Рис. 27. И снова попытка втиснуть содержание двух очерков про Дикарболлиды в одну страничку тезисов на научной конференции. Кстати, именно эти очерки фигурировали на конференции в качестве стендового доклада, и поступило немало пожеланий получить их полный текст. Пожалуйста. И иллюстрации на плакате из рис. 31, III.2. тоже посмотрите
Да... "В общем непонятно" и "еще менее понятно..." При этом автор широко пользуется представлениями о резонансе Ферми и все, что возможно, на него валит. Но когда перед ним три или даже четыре интенсивные линии, а связь С≡С между тем одна, как, например, у метилфенилацетилена, то тут уж не до резонансов (рис. 28).
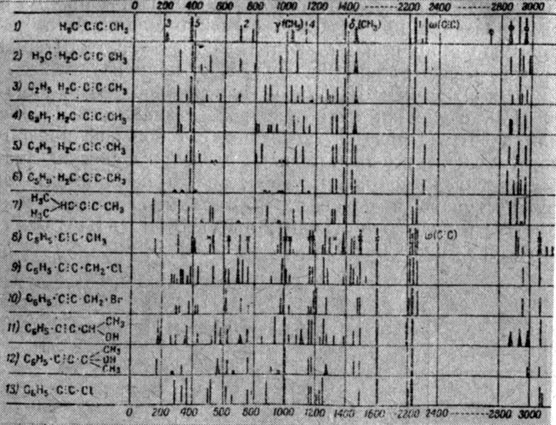
Рис. 28. Спектры KPG некоторых производных ацетилена по Кольраушу
Мы не будем проверять по литературе*, насколько далеко наука по производным ацетилена продвинулась вперед с военных времен, насколько убедительно разрешен процитированный нами парадокс с "лишними" линиями метилфенилацетилена. Просто мы приведем абсолютно конкретный пример, как весьма похожий случай с набором "лишних" линий удалось разобрать с позиций структурной химии. Причем, как выяснилось, за достаточно невинными "лишними" линиями стоит абсолютно новое, неизвестное в химии "явление подвижности двойных связей в сопряженных диеновых соединениях". Зарегистрированное в 1975 г. в Госкомитете по делам изобретений и открытий, это открытие явилось, "по оценке экспертов, одним из величайших достижений мировой органической химии за последнее десятилетие"**. Неплохой урок для любителей скоропалительных выводов о всевозможных резонансах. Резонансы, конечно, существуют, никуда от них не денешься, но и для них тоже нужны доказательства, и доказательства убедительные. А так, походя, мол, резонанс это и все тут - нет, так работать с "лишними" линиями совершенно невыгодно.
* (Профессор Ю. Л Фролов из Иркутска еще в начале 1988 г. уверял автора, что "воз и ныне там", где оставил его Кольрауш.)
** (Конюшая Ю. П. Открытия советских ученых.- М.: Моск. рабочий, 1979.- С, 522.)
С другой стороны, просто отвергнуть резонанс недостаточно для того, чтобы сделать открытие. А ну как ваша "лишняя" линия связана с элементарным загрязнением препарата? Или с реакциями, в том числе и фотохимическими, инициированными при препарировании или записи спектра? Или... Думаете, не бывает подобных эффектов? А может, они исключительно редки? Ничего подобного, встречаются они настолько часто, что с этим приходиться считаться буквально на каждом образце. Спросите, как? Ну, здесь особенно важен личный опыт спектрохимика или просто препаратора: менять условия препарирования, брать разные среды... Впрочем, далеко не все приемы личного опыта можно описать в очерке - все это приходит с годами работы и нуждается в подробной детализации.
Вернемся к диенам. "Лишние" линии в спектре впервые обозначились в тетраметилциклопентадиене. Действительно, в пятичленном цикле две двойные связи, и максимальное число линий для индивидуального соединения в характеристической области колебаний С=С - тоже два. А в том, что соединение индивидуально, тут обычно поставляющие молекулы химики поразительно однообразны, готовы принести самые страшные клятвы, подробно рассказать о схеме синтеза, процедуре перегонки на какой-нибудь стотарелочной колонке. Ну как тут не поверить? Но перед глазами "живой" спектр, и он вступает в противоречие с химическими данными. И очень было бы при этом хорошо, если бы возможность списать на резонанс то, что непонятно, была перед этим достаточно убедительно скомпрометирована конкретным примером, внушающим известную опаску опростоволоситься.
Так вот, в индивидуальном тетраметилциклопентадиене максимальное число линий в области С=С не должно превышать двух. А в препарате, попавшем на исследование, их не две, а целых пять!
Позвольте, но ведь циклопентадиены удивительно легко вступают в реакцию диенового синтеза. Одна молекула играет роль диена, другая - диенофила. И образуется димер, тоже имеющий в структуре две двойные связи, причем структурно разные. Вот вам и объяснение.
Ну что тут можно ответить? Конечно, такая реакция идет и димер образуется. Но если вы уже работали с самим циклопентадиеном, незамещенной молекулой, то научились и отделять мономер от димера непосредственно перед съемкой спектра, и различать линии димера на фоне линий мономера, и следить за их накоплением во времени. В общем эта препаративная задача относительно несложная, и при всех рассуждениях следует иметь в виду, что подобная возможность, конечно, анализировалась и исключалась. Да и накопленный спектрохимический опыт по пятичленным гетероциклам говорил о том, что в данном случае мы явно имеем дело со смесью нескольких молекул, скорее всего различным образом замещенных тетраметилциклопентадиена.
Опыт - это, конечно, хорошо. Но ведь не станешь же на него ссылаться в статье - дескать, мой опыт является аргументом в пользу... Опыт обычно стоит за публикацией, гарантирует от возможных ошибок - ведь каждое твое слово когда-то будет проверено другими. А тут надо что-то более убедительное, хотя бы тот же "живой" спектр.
Если вы уверены, что держите в руках смесь разных молекул, у вас есть одна интересная возможность сие проверить. Если вы химик и ведете синтез сами - попробуйте провести тот же синтез в несколько других условиях. Или в тех же, но еще раз. И еще раз. И каждый раз вы должны тщательно следить, как реагирует на изменения или повторы "живой" спектр. Следите за точными значениями частот и особенно интенсивностями, относительными интенсивностями линий.
Впрочем, в самой спектроскопии столько экспериментальных тонкостей, столько возможностей напутать с интенсивностями и прочим, что гораздо выгоднее разделить труд. Ну, скажем, так, как было в этот раз,- один синтезирует и очищает, другой колдует со спектрами.
Так вот, чтобы доказать, что у нас в руках именно смесь молекул, пришлось идти на поклон к химику-поставщику. А нет ли еще какого-нибудь образца тетраметилциклопентадиена, полученного, например, каким-либо другим способом или в другое время?
К счастью, оказалось, что есть. Синтезы в этой области велись уже по крайней мере года три, и образцов накопилось предостаточно. И накопилось много непонятного. Например, ведутся многостадийные синтезы, в которых должны получаться разные изомеры. А полученные продукты по химическим критериям имеют одинаковые свойства. Да уж не бензольные ли качества у этого самого циклопентадиеиа, может, все связи тут одинаковы и поэтому тетраметилзамещенный цикл всегда один и тот же?
Итак, в лаборатории новый образец. Препарирован, перегнан, поставлен на съемку. Вот видите, что я говорил, тут уже картина явно другая, соотношение интенсивностей сильно изменилось. А это значит, что неиндивидуальность первого образца строго доказана!
А в голове достаточно безумная мыслишка. А ну, дай-ка погрею я слегка новый препарат. Не слишком, конечно, сильно и не слишком, конечно, долго, чтобы не успел весь димеризоваться. Потом перегоню для отделения от димера и снова сниму спектр.
Эксперимент не очень сложный, и его можно провести в считанные часы. На колебания времени нет, будь что будет. Снят спектр, пластинка проявлена и...
...И спектр комбинационного рассеяния препарата номер два как две капли воды оказался похожим на спектр препарата номер один. И эти изменения произошли всего за полчасика и при температуре не выше 70 °С.
Попробовали бы вы тогда сами объяснить какому-нибудь химику, что у вас произошло в спектральной кювете. Попробовали бы доказать, что углеводородная молекула в столь щадящих условиях, да за столь короткое время, да без всяких катализаторов, сама собой взяла вот так запросто и изомеризовалась. Да вас просто бы засмеяли.
Но за плечами химика-соавтора уже три года безуспешных попыток получить индивидуальные изомеры. А три года негативного опыта кое-что да значат. И спектры - вот они, прямо перед глазами на спектральной фотопластинке...
Позвольте, а зачем нужно кому-то верить вот так вот просто, на слово. Ведь если явление действительно существует, то его можно проверить не только спектральными, но и любыми другими методами, в том числе и химическими. Да и производных у циклопентадиена много, например самый простой, где один атом водорода замещен на дейтерий. Или чуть сложнее - один атом водорода замещен метильной группой. И так далее. И дабы не рисковать возможной изомеризацией при щадящей температуре (а чем все-таки черт не шутит, вдруг на самом деле подобное чудо происходит), можно разгонку продуктов синтеза проводить на той же высокотарелочной колонке, но в вакууме, когда температура кипения вещества намного ниже стандартной. И сразу же помещать образец в сухой лед и в таком виде доставлять его к спектральному прибору.
Так, собственно говоря, дальнейшая работа и пошла. Синтез, разгонка, съемка. Синтез, разгонка, съемка. А спектр - это уже документ, и документ исключительно информативный. Скажем, стоит препарат в приборе, непрерывно снимается спектр - и за какой-нибудь час при комнатной температуре одна линия уходит совсем и сменяется другой. Да, именно так и было с образцом 5-монометилциклопентадиена, здесь изомеризация прошла быстрее, чем у других производных.
Постойте-ка, а если мы заполним этим изомером газовую кювету ИК-спектрометра, что увидим там?
И там увидели. Идет изомеризация, и весьма активно. Правда, скорость ее в газовой фазе оказалась в несколько раз меньше, чем в жидкости. До идет!
Интереснейший момент впервые обнаружен именно на монометилпроизводном. Оказалось, что, протон, отрываясь из положения 5 кольца, перемещается сначала в соседнее положение, причем реакция завершается в считанные десятки минут. После этого - резкое замедление. Но только замедление, процесс пе остановлен. И в жидкости, и в газе очень хорошо прослеживается и следующая стадия, т. е. образование 2-метилциклопентадиена до достижения равновесного состава смеси, в которой 1- и 2-изомеры примерно в равных количествах, а 5-изомер - в следовых (см. рис. 31, IV.1).
А если заместитель у нас будет совсем нейтральным, ну, скажем, вместо водорода возьмем его изотоп - дейтерий? Каков будет состав равновесной смеси изомеров?
Спектроскопия и здесь оказалась на высоте. Ведь колебательные спектры реагируют не только на структурные изменения или изменения силы химических связей между атомами. Здесь также важна и масса колеблющихся атомов. Измените массу - сразу частотные сдвиги, которые, кстати, весьма несложно и предсказать.
Не будем раскрывать все тайны спектрохимии, скажем только, что для дейтерозамещенного циклопентадиена состав равновесной смеси изомеров был определен методом комбинационного рассеяния света как 1:1:1. Здесь ведь не проверишь эту цифру методами химическими, как в случае с метилзамещенными образцами, даже газовая хроматография и та пасует. Так что пришлось здесь химикам поверить спектроскопистам на честное слово и не довелось в этом позже раскаяться. Кстати, именно на дейтерозамещенном было убедительно показано, что миграция протонов (и дейтронов) проходит по внутримолекулярному механизму... Потом была большая кропотливая работа, завершившаяся в 1975 г. регистрацией ОТКРЫТИЯ (рис. 29). Разные методы, разные доказательства, разные диены. Но начало всей этой работе было положено именно теми несколькими "лишними" линиями в образце тетраметилциклопептадиена. И известной долей внушенного старшими наставниками скепсиса по отношению к скоропалительным выводам о резонансе по Ферми. Но был уже при этом за плечами опыт работы с сотнями индивидуальных соединений, без чего спектрохимик никогда не сможет стать спектрохимиком.

Рис. 29. Эта таблица колебаний С=С связей в индивидуальных производных замещенных циклопентадиенов выплыла буквально из хаоса 'лишних' линий. Но если вы научились этими лишними' управлять по своему желанию, убирать их из спектра ли, наоборот, вводить, построить подобную таблицу особого труда вам уже не составит. А вот довести работу до уровня Открытия - здесь труд еще очень большой и не для одного человека
Первая публичная проба начальных, еще неопубликованных работ по новому эффекту была проведена в апреле 1962 г. на ежегодной юбилейной конференции молодых ученых СО АН СССР, посвященной ленинским дням. Рецензентом по докладу В. А. Миронова (ИОХ, Москва) и Е. В. Соболева (ИНХ, Новосибирск) выступил молодой кандидат наук Валентин Афанасьевич Коптюг, блестящий отзыв дал и директор НИОХ Николай Николаевич Ворожцов. Диплом первой степени, подписанный в числе других основателями Сибирского отделения академиком Михаилом Алексеевичем Лаврентьевым, и академиком Сергеем Львовичем Соболевым,- неплохой документ для популяризации "лишних" линий.
А только ли водород способен на перемещения по циклу? Вот, например, молекула спирононадиена - тот же циклопентадиен, но уже дважды замещенный в вершине кольца. А что, если и его слегка погреть? Справедливости ради следует сказать, что здесь пришлось греть несколько интенсивнее, температуры ниже 200 °С не срабатывали. Но все равно оторвался в конце концов из положения 5 один из углеродных хвостов и переместился в соседнее по кольцу положение, а дальше уж пошло... Похоже, что это превращение было первым сознательно проведенным карбонотропным превращением в углеводородах без использования катализаторов, только за счет температуры, и температуры относительно щадящей (см. рис. 31, IV.2). Правда, публикации 1963 и 1964 гг. прошли в науке, по-видимому, не слишком шумно, и приоритет на открытие явления карбонотропии от 19 марта 1969 г., закрепленный за тремя химиками из Ростова-на-Дону дипломом № 146, вряд ли от этого будет серьезно поколеблен, но… Приятно все же, что ты догадался первым.
Итак, "лишние" линии в колебательных спектрах, что-то вы откроете в следующий раз? И почему вас так много у производных ацетилена?
|
ПОИСК:
|