
Адиабата
Изучим теперь немного подробнее, как ведет себя газ в термосе, когда к нему не подводится тепло и от него оно не отбирается. В этом случае температура газа изменяется только за счет внутренней энергии газа.
Если сосуд с газом теплоизолирован, то работа, которая совершается над газом, или работа, которую совершает газ, будет единственным источником изменения его внутренней энергии:
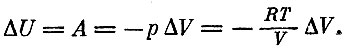
Если бы газ нагревался при постоянном объеме, то изменение энергии определялось бы лишь теплом, которое подводится к телу. В этом случае можно написать для энергии другую формулу:
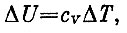
где cv - теплоемкость газа (на один моль) при постоянном объеме. Эта формула есть просто определение величины cу Написанные две формулы отражают тот факт, что изменение внутренней энергии может происходить двумя путями: за счет тепла и за счет работы. Поэтому ΔU можно сосчитать, заменив адиабатический процесс на другой, состоящий из двух этапов. Сначала изменяют температуру при постоянном объеме. Тогда U увеличится на cvΔT. После этого дают газу расширяться при T=const. При этом значение U будет оставаться постоянным, а совершенная газом работа как раз компенсирует то количество теплоты, которое было подведено на втором этапе. Приравнивая ΔU, вычисленное двумя способами, получаем
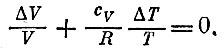
Если cv не зависит ни от Т, ни от V (это верно для не очень больших изменений температуры идеального газа), то такое уравнение можно решить. Легче всего проверить, что если мы положим
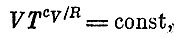
то уравнение будет удовлетворено. Проверить это можно, подставив вместо V и Т слегка измененные величины V+ΔV и Т+ΔТ , Мы убедимся, что const не изменится, если пренебречь (ΔV)2, (ΔТ)2 иΔV*ΔT, Если вместо Т ввести давление, то формула примет вид
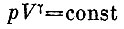
(постоянная здесь, конечно, другая) , где
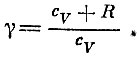
Заметим еще, что величина R численно равна работе, которую совершает один моль идеального газа, если его температура повышается на один градус, а давление остается постоянным:
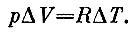
Если нагревать газ не при постоянном объеме, а при постоянном давлении, то надо подвести к нему дополнительно R джоулей на моль, чтобы компенсировать потерю его энергии, затраченной на расширение газа (это знал еще Карно)*.
* (Формулой pVn=const, где n -некоторое число, описывают приближенно процессы с обычными газами.)
Величину cv+R называют теплоемкостью при постоянном давлении и обозначают ее через сp. Поэтому
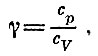
и связь между давлением идеального газа и его объемом в адиабатическом процессе имеет вид
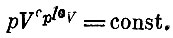
Эту формулу называют уравнением адиабаты ).
|
ПОИСК:
|