
Кинетическая энергия молекул и температура
Теперь нам остается связать удары молекул с температурой. Сформулируем сначала два предположения, которые позволят получить формулу Уотерстона. Так же, как и он, будем считать, что когда газ находится в тепловом равновесии, то: 1) молекулы газа сталкиваются лишь со стенкой и не сталкиваются между собой; 2) молекулы сталкиваются со стенкой упруго. Первое предположение означает, что мы имеем дело с идеальным газом, второе, как мы уже говорили, ничего не изменяет в результате, но упрощает вывод.
Теперь все совсем просто. Если формулу для давления переписать в виде 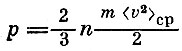 воспользоваться уравнением Менделеева - Клапейрона p=RT/V, то можно получить
воспользоваться уравнением Менделеева - Клапейрона p=RT/V, то можно получить
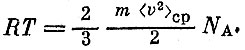
Мы заменили произведение nV на постоянную Авогадро NA, так как по смыслу уравнения Менделеева - Клапейрона V есть объем одного моля, а n - число частиц в 1 см3.
Если обозначить R/NA через k, то получим
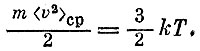
Постоянная k носит название постоянной Больцмана (она была введена Планком в 1899 г.).
Последняя формула показывает, что температура служит мерой кинетической энергии молекул. Если газ одноатомный, то вся его энергия есть энергия поступательного движения (для газа, молекулы которого состоят из нескольких атомов, формулы оказываются немного сложнее).
Для одной из компонент скорости (например, vx) мы можем написать
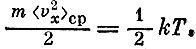
Такие же формулы мы можем написать и для двух остальных компонент. Говорят, что атом имеет три степени свободы, понимая под этим, что его движение задается тремя компонентами скорости.
Формулы выглядят так, как будто бы на каждое из трех возможных перпендикулярных направлений движения приходится энергия, равная (в среднем) 1/2kТ на каждую молекулу. Это утверждение - частный случай общего закона равнораспределения, породившего много споров в прошлом веке.
Достойно удивления, что все тот же Уотерстон докладывал в 1851 г. Британской ассоциации: "Равновесие по давлению и температуре между двумя газами имеет место, когда числа атомов в единице объема равны и когда живая сила каждого атома одинакова". Если заметить, что "живой силой" называли кинетическую энергию (в отличие от "мертвой силы" - силы в современном смысле этого слова)*, то мы увидим в этом утверждении следствие закона равнораспределения. Но и на этот раз никто не обратил внимания на доклад Уотерстона.
* (*Как мы уже отмечали, в XVIII веке разница между силой и энергией не была еще четко понята. "Силу", заключенную в летящей пуле, путали с силой сжатой пружины. Лейбниц ввел название "живая сила" для кинетической энергии (в действительности, удвоенной величины кинетической энергии - mv2) и "мертвая сила", например, для силы давления гири на подставку. Эта путаница осталась в названии "лошадиная сила" - еще недавно употреблявшейся единицы мощности.)
Формула Уотерстона связывает две величины, природа которых его почтенным оппонентам представлялась несравнимой. Формула связывала энергию частиц с температурой и придавала, наконец, физический смысл понятию температуры - по крайней мере, температуры одноатомного идеального газа. И хотя сам автор не мог видеть всего богатства своей формулы, но именно ей суждено было стать первой формулой кинетической теории газов.
|
ПОИСК:
|