
Как зависит S от температуры?
Доказательство формулы Больцмана для газа, в котором меняется температура, существенно более сложно. Мы приведем не вполне строгое рассуждение.
Для этого вспомним, что мы говорили в связи с распределением скоростей Максвелла. Будем следить за тем, как движутся атомы в пространстве скоростей, т. е. как изменяется скорость атомов со временем. В отличие от обычного пространства, пространства координат, в котором атом мог находиться в любой точке с равной вероятностью, в пространстве скоростей его "координаты" v принимают лишь значения, близкие к среднему значению скорости:
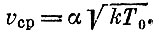
Мы не будем уточнять, о какой средней скорости идет речь - среднеквадратической, наиболее вероятной и т. д., и оставим коэффициент α без внимания. Скорость атомов, как это следует из распределения Максвелла, не равна точно vcp. Но можно сказать, что большая часть атомов имеет скорость, которая отличается от vcp не более чем на
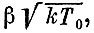
где β - еще одна постоянная, точный смысл которой нам не важен.
Такое утверждение можно оправдать, если вспомнить, что говорилось о дисперсии - разбросе значений v2 (или энергии) около среднего значения (строгое обоснование его сложно). Можно сказать, что в пространстве скоростей подавляющая часть молекул оказывается в объеме, все точки которого находятся на расстоянии, не большем, чем примерно
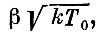
от точки, отвечающей значению компонент средней скорости.
Теперь можно сказать, что в пространстве скоростей почти все атомы находятся в объеме, примерно равном β3 (kT0)3/2. Если температура газа изменилась до значения T, то этому изменению в пространстве скоростей отвечает картина, в которой почти все атомы "столпились" в меньшем объеме, если Т <Т1 или "разбежались" в больший объем, если Т >Т0.
Вычислить вероятность такого события совсем просто. Надо действовать так же, как действовали мы при вычислении вероятности "собирания" газа в меньший объем в обычном пространстве. Вероятность эта равна
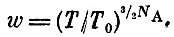
Заметьте, что коэффициенты αи β исчезли из формулы - потому-то мы не стали ими интересоваться.
Энтропия равна логарифму этого выражения, умноженному на R. Значит,
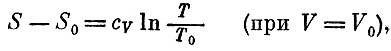
так как cv=3/2NAk есть теплоемкость 1 моля одноатомного газа при постоянном объеме.
Выведенная формула совпадает с той, которая была получена из термодинамики. Однако если сравнить этот вывод со старым выводом, в котором вычислялось количество теплоты и работа и совсем не упоминалась вероятность, то приходится удивляться, сколь разные точки зрения в физике приводят в конце концов к одним и тем же формулам. Возможность смотреть на физические явления с самых разных точек зрения - характерное свойство современной науки. Научиться этому; - первейшая задача естествоиспытателя.
|
ПОИСК:
|