
§ 14. Температура - мера средней кинетической энергии поступательного движения молекул
В § 8 указывалось, что температура является мерой средней кинетической энергии поступательного движения молекулы. Используя основное уравнение кинетической теории газа и уравнение состояния идеального газа, докажем математически, что это действительно так.
Помножив и разделив на два правую часть основного уравнения кинетической теории газа
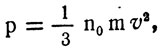
получим
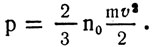
Возьмем киломоль газа Правую и левую части этой формулы помножим на объем 1 кмоля V0 газа:
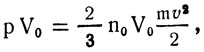
где n0V0 = NA;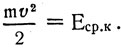 Здесь Еср.к - средняя кинетическая энергия поступательного движения одной молекулы газа.
Здесь Еср.к - средняя кинетическая энергия поступательного движения одной молекулы газа.
Тогда
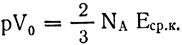
Для одного киломоля уравнение состояния идеального газа:
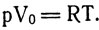
Приравниваем правые части последних двух уравнений:
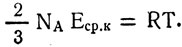
Отсюда
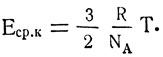
Здесь отношение двух постоянных величин 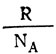 есть тоже величина постоянная, она называется постоянной Больцмана (обозначается буквой k):
есть тоже величина постоянная, она называется постоянной Больцмана (обозначается буквой k):
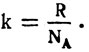
Тогда 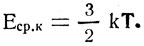
Это формула средней кинетической энергии поступательного движения одной молекулы. Из формулы видно: чем больше кинетическая энергия поступательного движения молекул, тем больше температура тела. Значит, температура характеризует интенсивность теплового движения молекул тела и является мерой средней кинетической энергии поступательного движения его молекул.
Левая часть последней формулы выражает энергию в джоулях, а правая - в градусах температуры. При вычислениях по этой формуле надо, чтобы обе ее части измерялись в одних единицах. Постоянная Больцмана и является переводным коэффициентом, определяющим соотношение между джоулем и градусом.
Вычислим постоянную Больцмана:
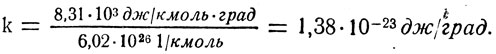
Постоянная Больцмана показывает, насколько изменяется энергия поступательного движения каждой молекулы газа при изменении температуры на 1°.
Задача 5. Определить среднюю скорость движения молекулы азота при 27° С. Молекулярная масса азота 28.
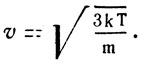
Отсюда искомая скорость
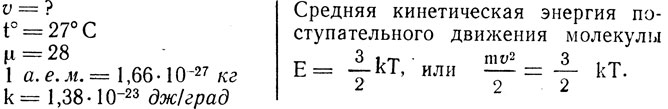
Масса молекулы любого вещества равна атомной единице массы, умноженной на молекулярную массу данного вещества:
m = 1 а. е. м. μ, m = 1,66*10-27 кг *28 = 46,48*10-28 кг.
Тогда 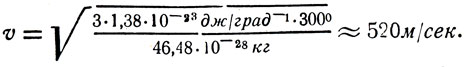
Отв.: v ≈ 520 м/сек.
|
ПОИСК:
|