
Многоэлектронные атомы. Теория периодической системы
Описанные модели, кроме модели Уайтеккера, опирались на периодический закон Д. И. Менделеева. Теория многоэлектронных атомов и периодической системы стала предметом усиленного внимания Бора. С наибольшей полнотой свои результаты в этом направлении Бор изложил в копенгагенском докладе 8 октября 1921 г. и в Нобелевской лекции о строении атома, прочитанной в Стокгольме 11 декабря 1922 г.
В 1918-1919 гг. проблемой многоэлектронных атомов, а именно атомов щелочных металлов, занимался Д. С. Рождественский. Бор знает работу Рождественского и обсуждает некоторые ее выводы. Он, как мы только что видели, обсуждает также атомные модели Льюиса и Лэнгмюра и соглашается с необходимостью перехода к пространственной структуре. На этот переход от плоских орбит к орбитам, заполняющим некоторый объем вокруг атома, сразу обратили внимание современники. Далее Бор обращает внимание на работы Косселя, связавшего распределение электронов по группам, определяемым рентгеновскими спектрами с физико-химическими свойствами атомов. Коссель связал периодичность в физико-химических свойствах атомов, отражаемую законом Менделеева с периодическим появлением особо устойчивых электронных группировок, характеризующих инертные газы, которые, как известно, замыкают каждый период. Электроотрицательный характер элементов, предшествующих в таблице инертному газу (например, хлора, предшествующего аргону), объясняется тем, что у него не хватает одного электрона для получения устойчивой группировки из 18 электронов, так же как электроположительный характер следующего за аргоном калия, который имеет лишний электрон по сравнению с устойчивой 18-электронной группировкой. Эти идеи Косселя развил далее Ладенбург (1920) для дальнейших периодов периодической системы. Работы Косселя и Ладенбурга продолжает и развивает Бор в своей теории периодической системы.

Д. И. Менделеев
Разделение электронов на группы подсказывается всем характером периодической системы. "С этой точки зрения,- говорит Бор,- разделение элементов на группы в периодической системе следует приписать постепенному образованию электронных групп в атоме по мере увеличения атомного номера". Отсюда возникает вопрос: каким образом образуется атом при последовательном захвате и связывании отдельных электронов в силовом поле ядра? Ответ на этот вопрос и дает теория периодической системы, по Бору. Заметим, что и Бор, и его предшественник Коссель указывают на Д. Д. Томсона как на пионера объяснения периодической закономерности с помощью электронных групп. "Со времени знаменитой попытки Дж. Дж. Томсона,- говорит Бор,- истолковать периодическую систему на основании исследования устойчивости различных электронных конфигураций идея о разделении электронов в атоме на группы сделалась исходным пунктом и более новых воззрений". Указав, что основная идея Томсоновского атома о распределении положительного заряда оказалась несостоятельной, Бор продолжает: "Тем не менее эта работа содержит много оригинальных мыслей и оказала большое влияние на дальнейшее развитие атомной теории".
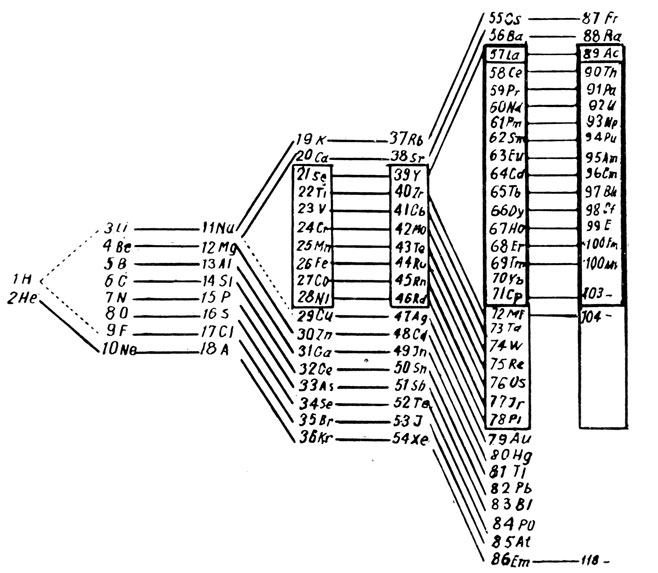
Периодическая система по Бору
Установив отправной пункт и сформулировав основной вопрос теории периодической системы, Бор переходит к анализу того, что дает квантовая теория в отношении общего характера процесса связывания электронов. Указав на существование для многоэлектронных атомов двух родов спектра, дугового и искрового, Бор показывает, что "дуговые спектры связаны с последней стадией образования нейтрального атома, т. е. с захватом N-го электрона. Искровой спектр излучается в предпоследнюю стадию захвата (N-1)-го электрона". При этом связываемый электрон в начале процесса связывания находится на значительных расстояниях от ядра, которые велики по сравнению с орбитами ранее захваченных электронов. Таким образом, он движется в поле ядра и (N-1) или (N - 2) электронов, которое совпадает с полем ядра водорода или гелия. Именно эту мысль высказал в свое время Рождественский, обнаружив водородоподобный характер отдаленных орбит валентного электрона щелочных металлов. Однако релятивистская поправка, введенная Зоммерфельдом, приводит к тому, что для многоэлектронных атомов прецессия орбиты и ее отклонение от эллипса будут больше, чем для водорода. Стационарные орбиты должны характеризоваться двумя квантовыми числами n и k. Далее эффект Зеемана и пространственное квантование приводят к необходимости введения третьего квантового числа, определяющего ориентировку орбиты относительно конфигурации ранее связанных электронов. Бор указывает, что Зоммерфельду введением "внутреннего квантового числа" (1920) удалось формально истолковать экспериментальные результаты сложной структуры спектральных линий щелочных металлов, предполагая, что это внутреннее квантовое число j имеет разные значения для обоих термов дублета. Бор говорит в связи с этим, что смысл третьего квантового числа пока точно не определен. Он упоминает далее о том, что с помощью третьего квантового числа Ланде в 1919 г. расширил модель щелочного атома, предположив, что оптический электрон совершает движение с тремя частотами (векторная модель), и на этой основе в 1921 г. построил формальную теорию аномального эффекта Зеемана. Описание Ланде основано на следующих принципах:
- Каждый терм характеризуется тремя квантовыми числами n, k, j и расщепляется в слабом магнитном поле на 2j + 1 термов с магнитными квантовыми числами m = j, j-1,..., +1, 0, -1, ..., -j.
- Отклонения расщепленных термов от нормального в единицах нормального расщепления представляются формулой g*m, где
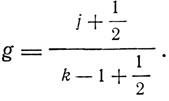
- Энергия щелочного атома в магнитном поле
W = W0(n, k, j) + h*o*mg,где
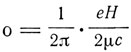 - угловая скорость прецессии Лармора, μ - масса электрона.
- угловая скорость прецессии Лармора, μ - масса электрона.
Бор в дополнении при публикации к своему докладу от 8 октября 1921 г. останавливается и на теории аномального эффекта Зеемана, предложенной Гейзенбергом в 1922 г. (эту работу Бор называет "только что появившейся"). В. Гейзенберг вывел расстояние между компонентами дублета, введя представление о чисто магнитном взаимодействии между орбитой оптического электрона с импульсом kh/2π и движением остальных электронов, которым приписывается импульс sh/2π. Гейзенберг получил для лития дублет правильного порядка величины. Напомним, что идея происхождения дублетов от магнитного взаимодействия была впервые высказана в 1919 г. Рождественским. Бор, признавая, что Гейзенбергом добыты "многообещающие результаты", считает, однако, что "способ использования им (Гейзенбергом) теории квантов в некоторых случаях едва ли совместим с общими предпосылками, лежащими в основе применений теории квантов".
Но общий вывод об описании движения электрона тремя квантовыми числами n, k, j, как это было предложено Зоммерфельдом и Ланде, Бор принимает.
Рассматривая процесс связывания электронов, Бор начинает с простейшего атома водорода. Здесь получается одновалентная круговая орбита, определяемая числами n = 1, k = 1. Для гелия дело обстоит сложнее. Два рода дугового спектра истолковывались как наличие в гелии смеси двух газов - ортогелия и парагелия. "В настоящее время мы знаем, однако,- замечает Бор,- что эти два спектра означают только то, что связывание второго электрона может происходить двумя различными способами". В связи с этим Бор ссылается на работу Ланде, рассматривающую два типа орбит гелия: плоские орбиты с двумя электронами и одно-электронные орбиты, плоскости которых образуют угол между собой. Он упоминает также о неопубликованной еще совместной работе с Крамерсом, указывая, что, хотя выводы этой работы во многих пунктах существенно отличаются от работы Ланде, они все же не согласуются с общими заключениями о происхождении орто- и парагелия. "Нужно думать, что в нормальном состоянии атома гелия оба электрона движутся в эквивалентных h орбитах (n = 1, k = 1). В первом приближении эти орбиты могут рассматриваться как круги, плоскости которых образуют угол в 120°",- говорит Бор. Он сообщает в этом месте о расчетах, предпринятых Крамерсом для атома гелия с пространственной конфигурацией орбит. "С тем приближением, с которым эти расчеты выполнены до настоящего времени, они заставляют надеяться на согласие с опытными результатами. Окончательный результат представит значительный интерес, так как даст возможность проверить на простейшем мыслимом примере те исходные пункты, с помощью которых делается попытка установить стационарные состояния атомов с числом электронов, большим одного".
К этому месту переводчик книги Бора на русский язык С. И. Вавилов дает дополнение о результатах расчетов Крамерса, опубликованных в 1923 г. Увы, результаты оказались неутешительными для теории Бора. Величина теоретического значения ионизационного потенциала гелия оказалась на 3,9 в ниже опытного значения 24,6 в. Модель, предложенная Бором, оказалась динамически неустойчивой. Вавилов, указывая, что система гелия входит составной неизменной частью в строение всех атомов периодической системы (кроме водорода), пишет в связи с результатами Крамерса, что "остается мало надежды теоретически объяснить устойчивость атомов и их ионизационные потенциалы, пользуясь законами механики и электростатики, хотя бы в том ограниченном размере, в котором эти законы успешно применяются в водородной системе". "Во всяком случае,- продолжает Вавилов,- неудача с моделью гелия лишает теорию Бора мощного орудия исследования - методов классической механики, и вся теория обращается почти в интуитивное угадывание истинных отношений".
Вся боровская теория периодической системы свелась к такому "почти интуитивному угадыванию истинных отношений". Ведь Бор еще не знал руководящего принципа построения периодической системы - принципа Паули. Вспоминая позже эти работы, Бор писал: "В те годы всеобъемлющие методы квантовой физики еще не были созданы и интерпретация экспериментальных данных основывалась главным образом на принципе соответствия, в котором выражена попытка сохранения классического описания до предельной степени, совместимой с индивидуальностью атомных процессов. Такая эмпирическая процедура позволила более или менее последовательно использовать спектральные данные для того, чтобы получить картину связывания электронов в атомах и, в частности, найти первый подход к интерпретации взаимоотношений между физическими и химическими свойствами элементов".
Подход Бора к интерпретации периодической системы определился, во-первых, данными об атомном номере и, следовательно, данными о числе электронов, подлежащих распределению по группам, во-вторых, структурой самой системы, где каждый период начинается щелочным металлом и заканчивается инертным газом, и, в-третьих, данными спектрального анализа, определяющими поведение оптического электрона и тем самым дающими, как думал Бор, сведения о том, как происходит процесс связывания электрона на последней ступени.
В результате Бор получил таблицу распределения электронов по орбитам, каждая из которых характеризуется двумя числами n и k и обозначается символом nk. В первом периоде - водород и гелий, электроны которых распределены но орбите 11 (один электрон у Н и два у Не). В следующем периоде электроны лития распределены по орбитам 11 и 21. Период заканчивается неоном, 10 электронов которого распределены так: два внутренних - на орбите 11, 4 - на орбите 21, 4 - на орбите 22. Эту конфигурацию из четырех орбит в каждом двухквантовом состоянии Бор считает замкнутой и устойчивой. Когда закончено связывание шести электронов, из которых два располагаются на орбите 11, а четыре на орбите 21, то присоединение седьмого электрона к орбите 21 нарушит симметрию. "Появление пяти подобных орбит, безусловно, нарушило бы симметрию взаимодействия электронов,- пишет Бор.- Нельзя себе представить, чтобы такой процесс присоединения пятого электрона был аналогичен согласно принципу соответствия с процессом, связанным с излучением спектра. Приходится предположить, что четыре электрона с их необычайной симметричной конфигурацией орбит удерживают новые электроны вдали, так что они связываются в орбитах другого типа".
По поводу конфигурации неона Бор пишет: "... в атоме неона, где необходимо предположить существование четырех 22 орбит, плоскости этих орбит обладают не только высокой степенью пространственной симметрии одна в отношении к другой, но образуют гармоническую конфигурацию и в отношении к четырем эллиптическим 21 - орбитам".
Идя последовательно от элемента к элементу, Бор показывает на основании спектроскопических соображений, как в ряде случаев происходит заполнение более высоких орбит, хотя внутренние еще не завершены постройкой. Впервые такое положение встречается у калия, где оптический электрон будет находиться на орбите 41, а не 33. Бор указывает, что сила связывания электрона на этой орбите (более чем в два раза больше, чем на круговых орбитах 33". Эти круговые орбиты заполняются только начиная со скандия. Особенно интересна группа редких земель, где заполнение внутренней оболочки 44 начинается у цезия, у которого есть четыре электрона в оболочке 5, четыре электрона в оболочке 52 и один электрон в оболочке 54. В связи с этим Бор говорил в своем нобелевском докладе:
"В шестом периоде мы встречаем новые соотношения. В этом периоде мы встречаемся не только с дальнейшей ступенью развития электронных групп с 5- и 6-квантовыми орбитами, но также и с окончательным завершением развития 4-квантовой электронной группы, которая вступает в нормальное состояние атома первым появлением орбит типа 44. Это развитие характерным образом выражается в появлении своеобразного семейства элементов, встречаемого нами в 6-м периоде и обозначаемого как редкие земли. Эти элементы, как известно, показывают гораздо большую родственность между собой, чем элементы семейства железных металлов, что происходит оттого, что мы имеем здесь дело с развитием электронной группы, глубже лежащей в атоме. Интересно отметить, что теория может также непринужденным образом дать отчет в том, что элементы, столь сходные друг с другом во многих отношениях, показывают, однако, сильные различия в своих магнитных свойствах. Мысль, что появление редких земель происходит от развития внутренней группы электронов, была предложена с различных сторон. Так, она была высказана Вегардом, и одновременно с работой докладчика эта мысль подробнее проведена Бери в связи со статической моделью атома Лэнгмюра и соображениями относительно систематической связи между химическими свойствами и. группировками в атоме. В то время как до сих пор не могло быть дано никакого теоретического обоснования для такого развития внутренней электронной группы, мы видим, как более детальное развитие теории квантов дает для этого столь непринужденное объяснение, что не будет преувеличением сказать, что если бы существование редких земель не было уже установлено прямыми химическими исследованиями, появление семейства элементов этого характера внутри 6-го периода периодической системы могло быть предсказано теоретически".
Этот теоретический анализ показывал, что группа редких земель должна заканчиваться элементом № 71 - лютецием. В то время элемент № 12 еще не был известен, однако Бор с уверенностью говорил 8 октября 1921 г.: "Теория ... позволяет заключить ... что электронная группа с четырехквантовыми орбитами полностью сформирована уже у лютеция (атомный номер 71). Этот элемент должен быть поэтому последним в ряде веществ с аналогичными свойствами в первой половине шестого периода; на месте 72 следует ожидать элемента гомологического по своим физическим и химическим свойствам циркону и тору".
В Нобелевской лекции Бор уже смог сообщить об открытии 72-го элемента, который был получен Костером и Хевеши в Копенгагене из минерала, содержащего цирконий. Этот элемент был ими назван гафнием по древнему названию Копенгагена (так же как лютеций происходит от древнего названия Парижа - Лютеция). Этот успех теории Бора вместе с тем демонстрирует силу периодического закона Менделеева. Периодическая система оказалась тем пробным камнем, на котором испытывалась молодая квантовая теория. Однако Бору еще не удалось найти настоящего ключа к периодическому закону. Его теория распределения электронных групп была весьма уязвимой. "Я живо вспоминаю дискуссии с Паули,- писал Бор в 1960 г.,- в которых он выражал неудовлетворенность слабостью аргументации, на которой основывалась попытка объяснить особую стабильность замкнутых электронных оболочек, имеющую столь фундаментальное значение для объяснения периодичности в свойствах элементов, расположенных в соответствии с зарядом их ядер". Вольфганг Паули, тогда еще молодой физик, вскоре отыскал ключ к периодической системе, о чем расскажем дальше.
|
ПОИСК:
|