
Фотохимический элемент
Одним из проявлений фотохимической активности вещества может служить упомянутое нами в начале главы возникновение разности потенциалов (обнаруженное в свое время Беккерелем) на зажимах химического элемента при освещении одного из его электродов. Чтобы говорить о возможности преобразования энергии в подобных элементах, необходимо, понять, почему именно разность потенциалов играет здесь основную роль.
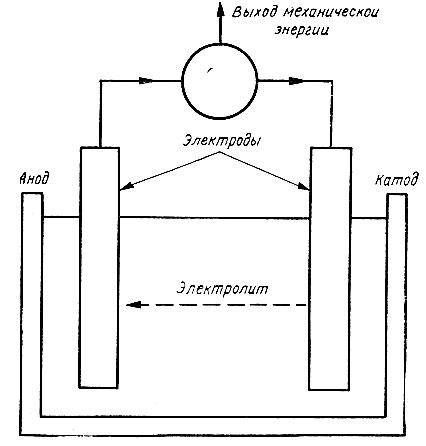
Рис. 79. Электрохимический элемент
Химический элемент (рис. 79) обычно состоит из двух металлических электродов, погруженных в вещество, называемое электролитом. Как правило, электролит представляет собой жидкость или пасту, состоящую из одного или нескольких соединений, или же раствор кислот, оснований или солей металлов. Если электроды элемента подключить к источнику тока, то через него может протекать электрический ток. Для этого в элементе должны существовать условия для переноса электронов через электролит от одного электрода к другому. Природа этих носителей являлась предметом многолетних обсуждений. Считается, что основы современной ионной теории, в рамках которой анализируются подобные процессы, были заложены в 1887 г. шведским химиком Аррениусом. Однако еще в 1883 г. Фарадей установил, что при прохождении тока через элемент происходит либо отложение металла, либо выделение газа на поверхности электродов, то есть в местах контакта электрод - электролит. Очевидно, там протекали электрохимические реакции. Фарадей показал, что функции носителей заряда выполняют компоненты соединений, из которых состоит электролит. Каждый из этих компонентов был назван ионом (что по-гречески означает "блуждающий"), а теперь так называют атомы или группы атомов (радикалы), имеющие избыток или недостаток электронов. Обладая определенным зарядом, ионы под действием кулоновских сил перемещаются к противоположно заряженному электроду и там "разряжаются" (нейтрализуются). Об этом процессе мы узнаем по числу электронов, отданных ионам (или полученных от них) соответствующего вещества, которое выделяется на электроде в виде нейтральных атомов твердого осадка или молекул газа. Впоследствии было обнаружено, что около электрода происходит и множество других процессов, в ходе которых осуществляется обмен электронами как между отдельными компонентами электролита, так и между ними и электродом.
Процесс возникновения ионов в электролитах не представляет из себя ничего таинственного. По отклонению рентгеновских лучей в различных материалах установлено, что многие соединения всегда находятся в ионной форме. Например, широко известная поваренная соль NaCl состоит из отдельных ионов Na+ и Cl-, находящихся в регулярной структуре; молекулы, как отдельной единицы, в твердом состоянии этого вещества не обнаружено. Отрицательный ион хлора Cl- образуется в результате присоединения к атому хлора электрона, отданного атомом натрия, который при этом превращается в положительно заряженный ион. Создается впечатление, что при встрече атомы состязаются в борьбе за электроны. При передаче электрона от одного атома к другому между ними возникает особого рода связь, и, кроме того, поскольку они заряжены, начинают действовать кулоновские силы. Однако при диссоциации такой соли в воде с увеличением расстояния между ионами эти силы ослабевают настолько, что ионы становятся совершенно не связанными. В последнем случае мы имеем так называемый сильный электролит.
Ионная связь является типичной формой связи для многих солей и оснований, тогда как для большинства кислот характерна ковалентная связь, при которой атомы не обмениваются электронами, а владеют ими сообща. В таких соединениях подобным же образом связаны между собой не только атомы, но и целые электронейтральные молекулы. Тем не менее в воде под действием определенных реакций многие из них разлагаются на ионы.
Поведение ионов в растворе довольно сложно. Будучи заряженными, они притягиваются или отталкиваются; кроме того, в процессе непрерывного теплового движения они находятся под влиянием множества других подобных ионов. Ионы взаимодействуют и с молекулами воды. При очень высокой концентрации растворенного вещества ионы оказываются близко друг к другу, и даже в сильных электролитах между ними возникают связи того же характера, что и в твердом теле. С другой стороны, в очень разбавленных растворах, даже в слабых электролитах, возможна почти полная ионизация. Следовательно, эффективная концентрация ионов в растворе, называемая активностью, может быть меньше фактической концентрации. По существу в слабом электролите число ионизированных молекул всегда поддерживается неизменным.
Что же происходит при погружении металлического электрода в электролит? Атомы электрода и ионы электролита вступают в реакции, в процессе которых они обмениваются электронами. Рассмотрим простейший пример, когда металлический электрод погружен в электролит, содержащий ионы того же металла. Здесь возможны два процесса. Атом металла, отдавая электрон, переходит в раствор в виде положительного нона, при этом на электроде образуется избыток электронов. Этот процесс можно представить уравнением
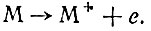
С другой стороны, возможен обратный процесс, когда ион из электролита, присоединяя электрон, выделяется на электроде в виде атома:

Оба процесса продолжаются до тех пор, пока не устанавливается равновесие, при котором их скорости сравниваются. В состоянии равновесия на электроде наблюдается избыток или недостаток электронов, то есть он оказывается заряженным. Величина его заряда определяет так называемый электродный потенциал. Поскольку процесс, определяемый уравнением (9.7), зависит от активности ионов электролита, то от нее зависит и потенциал электрода.
Далее, если подобрать пару электродов с различными электродными потенциалами и соединить их внешней цепью, то под действием разности потенциалов в ней потечет электрический ток. Тогда мы получим электрохимический элемент, показанный на рис. 76. При протекании тока ионы будут перемещаться к электродам до тех пор, пока связанные с этим изменения концентрации не уменьшат разность потенциалов между электродами до нуля. Элемент разряжается. Для поддержания тока во внешней цепи следует обеспечить такую активность ионов вблизи электродов, при которой между электродами сохраняется [необходимая разность потенциалов. К простейшим относится- элемент, в котором оба электрода из одного металла погружены в раствор, содержащий ионы того же металла. В таком элементе разность потенциалов возникает лишь в том случае, если активность ионов вблизи электродов различна. В слабом электролите различие в активности можно получить освещением одного из электродов, как в опыте Беккереля. Мы уже видели, что радиация вызывает самые разнообразные эффекты - от простейшего возбуждения до эмиссии электронов из атомов. Большинство таких эффектов приводят к нарушению равновесия в процессах (9.6) и (9.7), происходящих на электродах. Таким образом, если один из электродов элемента освещать солнечными лучами, то благодаря поглощению энергий световых фотонов электроны могут проходить через внешнюю цепь и совершать там работу.
Однако до сих пор еще не обнаружены реакции, в которых указанные процессы происходят с достаточно высоким к. п. д. Тем не менее принципиально возможно осуществление целого ряда таких реакций, например, под воздействием ультрафиолетового излучения, фотоны которого имеют достаточно высокую энергию. К. п. д. фотохимического элемента определяется в основном тремя факторами. Во-первых, к. п. д. процесса поглощения солнечной энергии. Как мы уже видели, он обусловлен квантовой природой этого процесса, и с учетом распределения солнечной энергии по длинам волн его максимальное значение не превышает 45%. Во-вторых, суммарный к. п. д. непосредственно зависит от соотношения скорости обратного процесса, или обратной реакции, и скорости миграции ионов к поверхности электрода, последняя определяется их подвижностью. Наконец, определенные изменения в электродных реакциях происходят при протекании тока во внешней цепи. Особенно серьезную проблему представляет перенапряжение, при котором потенциал электрода зависит от плотности тока. Оно обусловлено главным образом ограниченной подвижностью ионов (вследствие взаимодействия с другими ионами они могут перемещаться между электродами лишь с некоторой средней скоростью). Так же, как и в фотоэлектрическом элементе, разность потенциалов на зажимах фотохимического элемента изменяется от максимального значения в режиме холостого хода до 0 в режиме короткого замыкания, а наилучшему режиму работы элемента соответствует некоторое промежуточное ее значение.
Если принимать во внимание не только неорганические, но и органические вещества, то можно назвать миллионы электродных реакций, пригодных для использования в фотохимических элементах. Современный уровень знаний в большинстве случаев не позволяет точно предсказать скорости протекания таких I реакций (а также связанных с нею факторов, в частности подвижности ионов). В последнее время отмечается повышенный интерес к изучению различных способов производства энергии, в том числе с использованием электрохимических и фотохимических процессов. Поэтому необходимо исследование всех реакций, которые могут оказаться перспективными в этом отношении. Ученые не теряют надежды, хотя полученные до настоящего времени значения суммарного к. п. д. для реакций, казавшихся весьма перспективными, очень разочаровывают.
|
ПОИСК:
|