
Закон Авогадро
Пусть вещество представляет собой смесь различных молекул. Нет ли такой физической величины, характеризующей движение, которая была бы одинакова для всех этих молекул, например для водорода и кислорода, находящихся при одинаковой температуре?
Механика дает ответ на этот вопрос. Можно доказать, что одинаковыми у всех молекул будут средние кинетические энергии поступательного движения mv2ср/2.
Это означает, что при данной температуре средние квадраты скорости молекул обратно пропорциональны массе частиц:
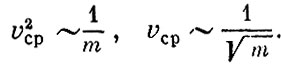
Вернемся теперь к уравнению 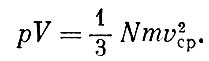 Так как при данной температуре величины mv2сp одинаковы для всех газов, то число молекул N, заключенных в данном объеме V при определенных давлении ρ и температуре Т, одинаково для всех газов. Этот замечательный закон был впервые сформулирован Авогадро.
Так как при данной температуре величины mv2сp одинаковы для всех газов, то число молекул N, заключенных в данном объеме V при определенных давлении ρ и температуре Т, одинаково для всех газов. Этот замечательный закон был впервые сформулирован Авогадро.
Сколько же молекул приходится на 1 см3? Оказывается, в 1 см3 при 0°С и 760 мм рт. ст. находится 2,7*1019 молекул. Это огромное число. Чтобы вы почувствовали, сколь оно велико, приведем такой пример. Положим, что газ удаляется из маленького сосудика объемом 1 см3 с такой скоростью, что в каждую секунду уходит миллион молекул. Нетрудно подсчитать, что сосуд полиостью освободится от газа через миллион лет!
Закон Авогадро указывает, что при определенных давлении и температуре отношение числа молекул к объему, в котором они заключены, N/V, есть величина, одинаковая для всех газов.
Так как плотность газа ρ = Nm/V, то отношение плотностей газов равно отношению их молекулярных масс:
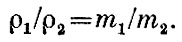
Относительные массы молекул могут быть поэтому установлены простым взвешиванием газообразных веществ. Такие измерения сыграли в свое время большую роль в развитии химии. Из закона Авогадро следует также, что для моля любого вещества,, находящегося в состоянии идеального газа, ρV = kNAT, где к - универсальная постоянная (она носит имя замечательного немецкого физика Людвига Больцмана), равная 1,38.10-16эрг/К. Произведение R=kNA называют универсальной газовой постоянной.
Закон идеального газа записывают часто как
ρV = μRT,
где μ - количество вещества, выраженное в молях. Это уравнение часто используется на практике.
|
ПОИСК:
|